


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 |
| B、由甘油和浓硝酸制硝化甘油炸药;由甲苯和浓硝酸制TNT炸药 |
| C、由氯代环己烷消去制环己烯;由丙烯加溴制1,2-二溴丙烷 |
| D、由乙醇和浓硫酸共热制乙醚;由乙醇和浓硫酸共热制乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图有机物A的分子,所含有的官能团的名称是
如图有机物A的分子,所含有的官能团的名称是查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A.目的:浓度对化学反应速率的影响 | B.目的:配制银氨溶液 |
加入 1mol/L 1mL硫酸 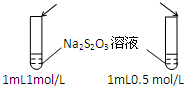 |
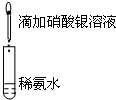 |
| C.目的:温度对化学平衡的影响 | D.目的:探究醋酸、碳酸、苯酚的酸性强弱 |
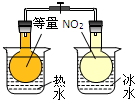 |
 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com