
 淡水是一种重要的自然资源,是人类赖以生存不可缺少的物质.按要求回答下列问题:
淡水是一种重要的自然资源,是人类赖以生存不可缺少的物质.按要求回答下列问题:分析 (1)混凝剂是溶液中水解生成胶体的盐类,净水作用是吸附悬浮杂质使其聚沉达到净化目的;除去难溶物后还有消毒、杀菌;
(2)软化水是除去钙镁离子;用一定浓度的食盐水浸泡可以使NaR型离子交换树脂再生;硬水中肥皂易生成沉淀;
(3)依据硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO),将水中的Ca2+、Mg2+质量折算成CaO的质量计算得到;
(4)硬水软化需要把钙离子和镁离子全部沉淀,加入氢氧化钙和镁离子、碳酸氢根离子反应,加入碳酸钠沉淀钙离子;
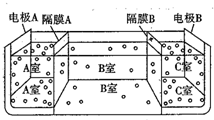
(5)①阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过;电解池的阴极是氢离子放电,阳极是氢氧根离子放电;
②电极A为阳极,电极B为阴极,电解池的阴极是氢离子放电,阳极是氢氧根离子放电.
解答 解:(1)混凝剂是吸附水中的微小悬浮颗粒,凝聚成较大的颗粒,而快速沉降的主要作用,要具备水解生成胶体的性质,所以常有铝盐或铁盐在水中发生水解生成相应氢氧化物胶体,如明矾,铝离子水解生成氢氧化铝胶体和氢离子,氢氧化铝胶体具有吸附性,所以能净水,硫酸铝,硫酸铁,硫酸亚铁也可以起到净水的作用;混凝剂吸附悬浮杂质使其聚沉达到净水的目的,另外溶液中还有病毒细菌等,有害物质,还要消毒、杀菌;
故答案为:明矾、硫酸铝、硫酸铁、硫酸亚铁;消毒、杀菌;
(2)水的软化是降低Ca2+、Mg2+的浓度,方法很多,有加热煮沸法、药剂软化法、离子交换法和电渗析法等;用5%~8%的食盐水浸泡可以使NaR型离子交换树脂再生;硬水中的钙镁离子与肥皂中的硬质酸根离子结合生成沉淀,从而失去洗涤能力,所以洗衣粉与肥皂相比洗衣粉洗涤效果更好;
故答案为:加热煮沸法、药剂软化法;5%~8%的食盐水;洗衣粉;
(3)某天然水中c(Ca2+)=1.2×10-3mol•L-1,c(Mg2+)=6×10-4mol•L-1,硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO);1L水中钙离子物质的量=1.2×10-3mol,相当于CaO质量=1.2×10-3mol×56g/mol=67.2mg,1L水中镁离子物质的量=6×10-4mol,相当于氧化镁质量6×10-4mol×40g/mol=24mg,所以水的硬度=$\frac{67.2mg}{10mg}$+$\frac{24mg}{7.1mg}$=10°;
故答案为:10°;
(4)10m3这种天然水水中含有钙离子物质的量=10×103L×1.2×10-3mol•L-1=12mol;镁离子物质的量=10×103L×6×10-4mol•L-1=6mol;碳酸氢根离子物质的量=10×103L×8×10-4mol•L-1=8mol;加入氢氧化钙发生的反应为:
Mg2++2OH-=Mg(OH)2↓ HCO3-+OH-=CO32-+H2O
1 2 1 1 1
6mol 12mol 8mol 8mol 8mol
共需氢氧根物质的量20mol;
需要Ca(OH)2物质的量10mol,氢氧化钙质量为74g/mol×10mol=740g,
水溶液中Ca2+物质的量为12mol+10mol=22mol,
其中需要加入的 碳酸根离子为22mol-8mol=14mol,需要碳酸钠的质量为14mol×106g/mol=1484g,
故答案为:740;1484;
(5)①电解池的阴极是氢离子放电,阳极是氢氧根离子放电,隔膜A是阴离子交换膜,隔膜C是阳离子交换膜,故答案为:阴;
②电极A为阳极,电极B为阴极,阴极是氢离子放电生成氢气和氢氧根离子,阳极是氢氧根离子放电生成氧气和氢离子,隔膜A是阴离子交换膜,隔膜C是阳离子交换膜,则导致A室显酸性,B室显中性,C室显碱性,所以pH大小顺序为:pHa<pHb<pHc,
故答案为:pHa<pHb<pHc.
点评 本题考查了盐类水解的应用、净水方法和软化原理、水的硬度计算等,需要理解题干信息,准确计算,题目难度中等,侧重于考查学生的分析能力和计算能力.


 高中必刷题系列答案
高中必刷题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,在pH=7的醋酸钠和醋酸混合溶液中:c(CH3COO-)>c(Na+) | |
| B. | 在pH=5的氯化钠和稀硝酸的混合溶液中,c(Na+)=c(Cl-) | |
| C. | 稀释醋酸溶液,溶液中所有离子的浓度均降低 | |
| D. | 0.1 mol•L-1的硫化钠溶液中,c(H+)+c(Na+)=c(OH-)+c(HS-)+c(S2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LSO3含有的分子数NA | |
| B. | 常温常压下,4.4gCO2的物质的量一定为0.1mol | |
| C. | 标准状况下,氧原子总数为0.2NA的SO2和O2的混合气体,其体积为2.24L | |
| D. | 7.8gNa2S和7.8gNa2O2中含有的阴离子数目均为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com