
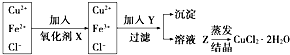
���� ��ҵ����ȡ������CuCl2•2H2O����Ҫ���̣���������ͭ��������Fe���ܽ���ϡ�����У�����ͭ�����ᷴӦ�����Ȼ�ͭ���������ᷴӦ�����Ȼ����������ˣ���Һ�к����������ӡ�ͭ���ӡ������ӣ��������������������������������ӣ�Ȼ�����Y������Һ��pH����������ת������������������ȥ���õ�����ҺZΪ�Ȼ�ͭ��Һ��Ȼ���ڳ���ͨ��HCl���岢���Ͻ���������������Һ�һ���Ȼ�ͭ���壬�Դ˽����⣮
��� �⣺��ҵ����ȡ������CuCl2•2H2O����Ҫ���̣���������ͭ��������Fe���ܽ���ϡ�����У�����ͭ�����ᷴӦ�����Ȼ�ͭ���������ᷴӦ�����Ȼ����������ˣ���Һ�к����������ӡ�ͭ���ӡ������ӣ��������������������������������ӣ�Ȼ�����Y������Һ��pH����������ת������������������ȥ���õ�����ҺZΪ�Ȼ�ͭ��Һ��Ȼ���ڳ���ͨ��HCl���岢���Ͻ���������������Һ�һ���Ȼ�ͭ���壮
��1����������ͼ��֪ʵ��Ŀ�����Ʊ��Ȼ�ͭ���壬��Ҫ��ȥ�������ӣ������XΪ�������������������µ����ʣ�X�ǹ���������Һ��������Һ��Ҳ����������������Ϊ�������Ҳ������µ����ʣ���Ӧ�����ӷ���ʽΪ��2H++H2O2+2Fe2+=2Fe3++2H2O��
�ʴ�Ϊ��H2O2��2H++H2O2+2Fe2+=2Fe3++2H2O��
��2��Y����Ӧ������Һ�����ԣ�������ҺPHʱ������ȫ��������ͭ���Ӳ��ܳ����Ҳ��������µ��������ӣ�ʵ����Ҫ������ᷴӦ�Ĺ�������CuO��Cu��OH��2����֪Cu2+��Fe2+��pHΪ4��5ʱ��ˮ�⣬��Fe3+������ȫˮ���������������ҺPHֵ4--5��ʹ��������ȫ������
�ʴ�Ϊ��BC��
��3��Y��CuO�������ᷴӦ����ͭ���Ӻ�ˮ��������ҺpH�������������ӵ�ˮ�⣬����ʽΪCuO+2H+=Cu2++H2O���ʴ�Ϊ��CuO+2H+=Cu2++H2O��
��4���Ȼ�ͭˮ��Һ����Ũ����ͭ����ˮ�⣬CuCl2+H2O?Cu��OH��2+2HCl�����ɵ��Ȼ���ӷ������ȴٽ�ˮ��������У��õ�������ͭ������ʵ����Ҫ���Ȼ�������������������ˮ�ⷴӦ���У������õ��Ȼ�ͭ���壻
�ʴ�Ϊ��ͨ��HCl���壨��������ᣩ�������Ͻ����Ҳ������ɣ�
���� ���⿼���������Ʊ�ʵ�鷽������ơ����ʵķ������ᴿ�����ۺ�Ӧ�ã���Ŀ�Ѷ��еȣ���ȷ�Ʊ����̼���Ӧԭ��Ϊ���ؼ�����Ҫע����Ӳ��������µ����ʣ�������ؿ���ѧ���ķ�����������������ѧʵ��������


 �ٷ�ѧ����ҵ��������ϵ�д�
�ٷ�ѧ����ҵ��������ϵ�д� ��������ϵ�д�
��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
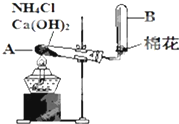 ��ͼ��ʵ�������Ȼ�狀���ʯ����ȡ������ʵ��װ��ͼ����ش����¸����⣺
��ͼ��ʵ�������Ȼ�狀���ʯ����ȡ������ʵ��װ��ͼ����ش����¸����⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
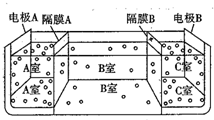 ��ˮ��һ����Ҫ����Ȼ��Դ���������������治��ȱ�ٵ����ʣ���Ҫ��ش��������⣺
��ˮ��һ����Ҫ����Ȼ��Դ���������������治��ȱ�ٵ����ʣ���Ҫ��ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
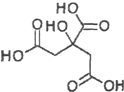
| A�� | X����ʽΪC6H6O7 | |
| B�� | X�ɷ���ˮ�ⷴӦ���ӳɷ�Ӧ��������Ӧ | |
| C�� | X����������̼ԭ�Ӿ���ͬһƽ���� | |
| D�� | 1mol����X��������Na��Ӧ�ɲ���2mol H2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ƺͼغϽ���е����ԣ������������ӷ�Ӧ���Ƚ����� | |
| B�� | ��������ˮ���ܲ���Al��OH��3���壬��������ˮ�� | |
| C�� | ˮ������Na2SiO3��������ˮ������������� | |
| D�� | Ũ���������ˮ�ԣ������ڸ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢܢ� | B�� | �ܢ٢ڢ� | C�� | �ۢڢ٢ڢ� | D�� | �ܢۢڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������ȼ�գ�����Ϊ����ɫ | |
| B�� | ��ˮ����ͭ����ҽ�þƾ��б��� | |
| C�� | ��Fe��NO3��2��Һ�еμ�ϡ���ᣬ��Һ����ɫ | |
| D�� | ��FeSO4��Һ�еμ�NaOH��Һ�����ɳ�������ɫ�ɰ�ɫѸ�ٱ�Ϊ����ɫ������Ϊ���ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ������ | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| ��ʼ����ʱ��pH | 2.7 | 7.0 | - | - | - |
| ������ȫ�ǵ�pH | 3.7 | 9.0 | 11.1 | 8 | 9����9�ܽ⣩ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com