

分析 (Ⅰ)焙烧炉中发生反应的化学方程式为2Al2(SO4)3+3S$\frac{\underline{\;高温\;}}{\;}$2Al2O3+9SO2,故生成炉气中含二氧化硫,熟料中含氧化铝、氧化铁、硫酸钾等,加入氢氧化钠和水,氧化铝和氢氧化钠反应生成偏铝酸钠,氧化铁不反应,过滤,滤渣中含氧化铁,滤液中含偏铝酸钠和硫酸钾、氢氧化钠等;用硫酸调节pH,得到氢氧化铝沉淀和硫酸钠、硫酸钾,过滤得母液中含硫酸钾、硫酸钠溶质,
(1)所含元素化合价降低的反应物是氧化剂;
反应中硫单质中硫元素化合价由0价升高为SO2中+4价,硫单质为还原剂,计算生成1molAl2O3需要硫的物质的量,转移电子是硫单质的4倍,再根据N=nNA转移电子数目;
(2)根据n=$\frac{V}{{V}_{m}}$计算二氧化硫的物质的量,根据n(SO2):n(NaOH)确定反应产物,再结合溶液呈酸性进行判断;
(Ⅱ)烧瓶中浓硫酸与亚硫酸钠固体反应生成硫酸钠、二氧化硫气体和水,据此写出反应的化学方程式;
(1)从除杂、催化氧化、冷却、吸收未反应的SO2,排除空气中水及二氧化碳的影响来分析;
(2)根据催化剂在一定的温度下催化效果好及反应速率来分析;
(3)SO2气体产生缓慢,根据发生的化学反应及影响反应速率的因素来分析;
(4)SO2通入含1mol氯酸的溶液中,可生成一种强酸和一种氧化物,有6.02×1023个电子转移,则Cl元素的化合价由+5价降低为+4价,并利用质量守恒定律来书写反应方程式;
(5)IV增重了mg,为未反应的SO2的质量,nmolNa2SO3粉末与足量浓硫酸反应生成nmolSO2,以此来计算转化率.
解答 解:(Ⅰ)(1)反应中硫元素化合价由Al2(SO4)3中+6价降低为SO2中+4价,故Al2(SO4)3是氧化剂,反应中硫单质中硫元素化合价由0价升高为SO2中+4价,硫单质为还原剂,生成1molAl2O3需要硫的物质的量为1mol×$\frac{3}{2}$=1.5mol,转移电子的物质的量为1.5mol×4=6mol,转移电子数目为6mol×6.02×1023mol-1=3.612×1024,
故答案为:Al2(SO4)3;3.612×1024;
(2)1.12L二氧化硫的物质的量为:$\frac{1.12L}{22.4L/mol}$=0.05mol,n(NaOH)=0.1L×0.5mol/L=0.05mol,n(SO2):n(NaOH)=0.05mol:0.05mol=1:1,故反应后溶液中溶质为NaHSO3,溶液呈酸性,说明HSO3-的电离程度大于水解程度,同时水电离生成氢离子,故c(H+)>c(SO32-),HSO3-电离程度不大,故c(HSO3-)>c(H+),溶液c(OH-)等于水电离生成,浓度很小,故溶液中离子浓度由大到小的排列顺序为c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-),
故答案为:c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
(II)装置中烧瓶内发生的化学反应方程式为:Na2SO3(s)+H2SO4(85%)$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+H2O+SO2↑,
故答案为:Na2SO3(s)+H2SO4(85%)$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO4+H2O+SO2↑;
(1)因从溶液中反应生成气体中混有水蒸气,则I处应选择B装置来吸收水进行气体的干燥,II中选E进行二氧化硫气体的催化氧化,S03的熔点是16.8℃,沸点是44.8℃,III中选A进行冷却,使三氧化硫与二氧化硫分离,在IV中选择C装置来吸收未反应的SO2,
故答案为:BEAC;
(2)因催化剂在一定的温度下催化效果好,则应先加热催化剂,然后滴加浓硫酸,
故答案为:先加热催化剂再滴入浓硫酸;
(3)SO2气体产生缓慢,可能为Na2SO3变质生成硫酸钠,也可能为浓硫酸的浓度不够,反应速率变慢,
故答案为:Na2SO3变质;浓硫酸的浓度不够;
(4)SO2通入含1mol氯酸的溶液中,可生成一种强酸和一种氧化物,有6.02×1023个电子转移,则Cl元素的化合价由+5价降低为+4价,由质量守恒定律可知反应的化学方程式为:SO2+2HClO3═H2SO4+2ClO2,
故答案为:SO2+2HClO3═H2SO4+2ClO2;
(5)IV增重了mg,为未反应的SO2的质量,其物质的量为:$\frac{m}{64}$mol,nmolNa2SO3粉末与足量浓硫酸反应生成nmolSO2,
则二氧化硫的转化率为:$\frac{n-\frac{m}{64}}{n}$×100%=$\frac{64n-m}{64n}$×100%,
故答案为:$\frac{64n-m}{64n}$×100%.
点评 本题考查了性质实验方案的设计,题目难度中等,涉及氧化还原反应的计算、离子浓度大小比较、性质实验方案的设计与评价等知识,明确实验目的及实验原理为解答关键,注意掌握性质实验方案设计的原则,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及化学实验、化学计算能力.


科目:高中化学 来源: 题型:选择题
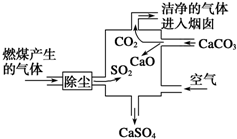
| A. | 进入烟囱的气体为混合物 | |
| B. | 此过程中硫元素的化合价没有发生改变 | |
| C. | 使用此废气处理装置可减少酸雨的形成 | |
| D. | 整个过程的反应可表示为2SO2+2CaCO3+O2═2CaSO4+2CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和CO2都是酸性氧化物,SO2与Na2O2反应生成Na2SO3和O2 | |
| B. | 84 g NaHCO3受热分解,将生成的气体通过足量的Na2O2,固体质量增加31 g | |
| C. | 将Na2O2投入到酚酞试液中,溶液变红 | |
| D. | Na2O2与水的反应中,Na2O2既是氧化剂,又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液由黄色变为浅绿色 | B. | 溶液由浅绿色变为黄色 | ||
| C. | 溶液由浅绿色变为血红色 | D. | 有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氯化铜溶液中加入氢氧化铁 | B. | 硝酸铝溶液中加入氨水 | ||
| C. | 氢氧化钾溶液中加入硫化铜 | D. | 碳酸氨中加入氢氧化钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅰ | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| Ⅱ | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| Ⅲ | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 被提纯的物质(杂质) | 除杂试剂 | 分离方法 |
| A | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| B | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 分液 |
| C | 乙醇(乙酸) | 新制生石灰 | 蒸馏 |
| D | 甲苯(苯酚) | 浓溴水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解饱和氯化钠溶液:2Cl-+2H+ $\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| B. | 用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-$\stackrel{水浴加热}{→}$CH3COO-+NH4++3NH3+3Ag↓+H2O | |
| C. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- | |
| D. | 苯酚钠溶于醋酸溶液:C6H5O-+CH3COOH→C6H5OH+CH3COO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com