
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据如图所示实验装置,回答下列问题:
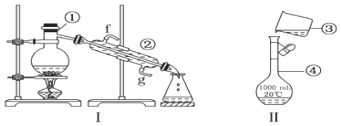
![]() 写出下列仪器的名称:
写出下列仪器的名称:![]() ______;
______;
![]() 若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器有______,将仪器补充完整后进行的实验操作的名称为______;
若利用装置Ⅰ分离酒精和水的混合物,还缺少的仪器有______,将仪器补充完整后进行的实验操作的名称为______;![]() 的进水口是______
的进水口是______![]() 填f或
填f或![]()
![]() 某同学用装置Ⅱ配制
某同学用装置Ⅱ配制![]() NaCl溶液,指出图中的错误操作______.
NaCl溶液,指出图中的错误操作______.
科目:高中化学 来源: 题型:
【题目】利用海洋资源获得的部分物质如下图所示,有关说法正确的是
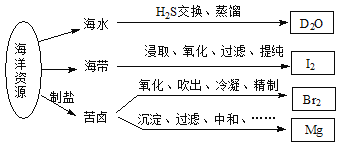
A. 在化学反应中,![]() H2O可转变为D2O
H2O可转变为D2O
B. “加碘食盐”生产中碘添加剂为单质I2
C. 实验室用带玻璃塞的棕色瓶贮存液Br2
D. 电解饱和MgCl2溶液时在阴极得到Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用无机矿物资源生产部分材料,其产品流程示意图如下,下列说法正确的是( )

A. 制取粗硅时生成的气体产物为CO2
B. 生产铝、铜、高纯硅及玻璃的过程中都涉及氧化还原反应
C. 电解精炼铜时,当电路中转移0.2mol电子时阳极质量减轻6.4g
D. 粗硅制高纯硅时,提纯四氯化硅可用多次分馏的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.实验室中常用排饱和食盐水的方法收集Cl2
B.洗涤油污时热的纯碱溶液比冷的纯碱溶液效果更好
C.浓氨水中加入氢氧化钠固体时产生刺激性气味的气体
D.工业上使用催化剂提高SO2与O2合成SO3的效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置甲是某可充电电池的示意图,该电池放电的化学方程式为2K2S2+KI3=K2S4+3KI,图中的离子交换膜只允许K+通过,C、D、F均为石墨电极,E为铜电极。工作一段时间后,断开K,此时C、D两电极产生的气体体积相同,E电极质量减少 1.28 g。

(1)装置甲的A电极为电池的__极,电解质的K+向__(填“左侧”或“右侧”)迁移;B电极的电极反应式为____。
(2)装置乙中D电极析出的气体是___,体积为____mL(标准状况)。
(3)若将装置丙中的NaCl溶液改换成FeCl2和FeCl3的混合溶液。从反应初始至反应结束,丙装置溶液中金属阳离子物质的量浓度与转移电子的物质的量的变化关系如图所示。
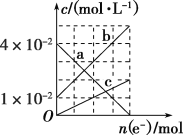
①图中b表示的是_____(填金属离子符号)的变化曲线。
②反应结束后,若用0.5 mol·L-1NaOH溶液沉淀丙装置溶液中的金属阳离子(设溶液体积为100 mL),则至少需要0.5 mol·L-1NaOH溶液______mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程:
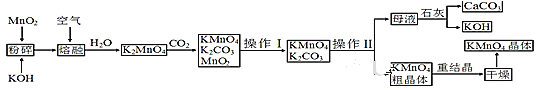
(1)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列___物质相似。
A.75%酒精 B.双氧水 C.苯酚 D.“84”消毒液(NaClO溶液)
(2)粉碎的目的是___;操作Ⅰ的名称是___;操作Ⅱ是根据KMnO4和K2CO3两物质在___(填性质)上差异,采用___(填操作步骤)、趁热过滤得到KMnO4粗晶体的。
(3)上述流程中可以循环使用的物质有石灰、CO2、___和___(写化学式)。
(4)向K2MnO4溶液中通入CO2以制备KMnO4,该反应中的还原剂是___。
(5)铋酸钠(NaBiO3,不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋元素的还原产物为Bi3+,Mn的氧化产物为+7价),写出反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的常见短周期元素,X的某种氢化物能使湿润的红色石蕊试纸变蓝.Y的一种核素质量数为18,中子数为10.在同周期元素中Z的简单离子半径最小,W的单质是良好的半导体材料。下列说法中正确的是
A. 简单气态氢化物稳定性:W >X
B. Y元素的相对原子质量为18
C. X2H4的分子中极性键和非极性键数目比为4:l
D. 电解Z的熔融氯化物可以冶炼单质Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+3、+5、+7,核电荷数按照Z、X、Y、W的顺序增大。已知Z的原子次外层的电子数为2,W、X原子次外层电子数为8。
(1)请写出元素Y的原子结构示意图_______________;其中元素W在周期表中的位置_______________________________。
(2)用电子式表示X在空气中生成的氧化物的形成过程:__________________________。
(3)X、Y、Z、W的原子半径由大到小的顺序为:_____________________________。(用元素符号表示)
(4)请写出W的单质与X的最高价氧化物对应水化物反应的离子方程式:_______________________________。
(5)写出Z与氢元素形成的10电子微粒化学式_____________________(任写两种)。
(6)元素X与元素Y相比,金属性较强的是_____(用元素符号表示),请举一例实验事实证明这一结论__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫原子的质量是a g,12C原子的质量是b g,若NA表示阿伏加德罗常数,则下列说法中正确的是
①该硫原子的相对原子质量为12a/b ②m g该硫原子的物质的量为m/aNA mol
③12C原子的摩尔质量是12g或bNA g ④a g该硫原子所含的电子数为16
A.①③④B.②③④C.①②④D.①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com