
下列有关实验装置(部分夹持装置已省略)进行的相应实验,能达到实验目的的是

A.用图1所示装置可制取Cl2
B.用图2所示装置可完成“喷泉”实验
C.用图3所示装置可制取并收集干燥纯净的NH3
D.用图4所示装置可用于实验室制取乙酸乙酯
科目:高中化学 来源:2014-2015河南省濮阳市高二上学期第三次月考化学试卷(解析版) 题型:选择题
关于下列各装置图的叙述中,不正确的是

A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省丹东五校协作体高三上学期期末考试理综化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值。下列叙述中不正确的是
A.16.9 g过氧化钡(BaO2)固体中阴、阳离子总数约为0.2NA
B.常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
C.标准状况下,0.1molCl2溶于水,转移的电子数目小于0.1NA
D.某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省镇江市高三第一学期期末调研测试化学试卷(解析版) 题型:实验题
(16分)绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
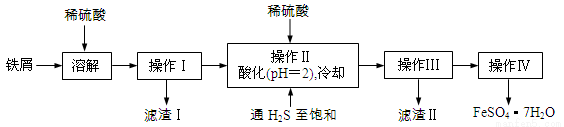
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)通入硫化氢的作用是:
①除去溶液中的Sn2+离子
②除去溶液中的Fe3+,其反应的离子方程式为 ;操作II,在溶液中用硫酸酸化至pH=2的目的是 。
(2)操作IV的顺序依次为: 、 、过滤、洗涤、干燥。
(3)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
② 。
(4)测定绿矾产品中Fe2+含量的方法是:
a.称取一定质量绿矾产品,配制成250.00mL溶液;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000 mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。滴定时发生反应的离子方程式为:5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O)。
①用硫酸酸化的0.01000 mol/LKMnO4溶液滴定时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 。
②判断此滴定实验达到终点的方法是 。
③若用上述方法测定的样品中FeSO4·7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省镇江市高三第一学期期末调研测试化学试卷(解析版) 题型:选择题
化合物Ⅲ是合成中药黄芩中的主要活性成分的中间体,合成方法如下:

下列有关叙述正确的是
A.I在空气中能稳定存在
B.II中所有原子均有可能共面
C.可用FeCl3溶液鉴别有机物II和III
D.1mol产物III与足量溴水反应,消耗Br2的物质的量为1.5mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省镇江市高三第一学期期末调研测试化学试卷(解析版) 题型:选择题
下列有关化学用语的表示正确的是
A.质量数为37的氯原子:
B.二氧化碳分子的比例模型:

C. NH4Br的电子式:
D.对羟基苯甲醛的结构简式:
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省苏州市高三上学期期末调研测试化学试卷(解析版) 题型:填空题
(12分)继侯德榜“联合制碱法”后,上世纪50年代某些化工专家开始研究有机胺制碱法,目前这项研究工作取得了一定进展。其工艺流程如下:

已知:NR3+ HC=NR3 HCl,且NR3 HCl易溶于有机溶剂。
(1)有机胺制碱法反应生成小苏打的化学方程式是: ;操作①称为 ;
(2)过程③得到产品的化学方程式是: ;
(3)在过程④中,回收有机胺的化学方程式是: ;
(4)副产品的用途 ;
(5)本工艺流程中可循环利用的物质是: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省郴州市高三第二次月考理综化学试卷(解析版) 题型:填空题
(15分)CO和NO是汽车尾气的主要污染物。消除汽车尾气的反应式之一为:
2NO(g)+2CO(g) N2(g)+2CO2(g)。请回答下列问题:
N2(g)+2CO2(g)。请回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g) △H= +180.5kJ/mol ①
C(s)+O2(g)=CO2(g) △H= -393.5kJ/mol ②
2C(s)+O2=2CO(g) △H= -221kJ/mol ③
则 2NO(g) + 2CO(g) N2(g) + 2CO2(g)△H= 。
N2(g) + 2CO2(g)△H= 。
(2)-定温度下,在一体积为VL的密闭容器中充人一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=amol、n(NO)=2amol、n(N2)=bmol,且N2占平衡混合气体总体积的1/4。
①该反应的平衡常数K= (用只含a、V的式子表示)。
②判断该反应达到平衡的标志是____(填序号)
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(3)在一定温度下,将2.0molNO、2.4molCO通入固定容积2L的密闭中,反应过程中部分物质的物质的量变化如图所示,则:

①有害气体NO的转化率是 ,0~15minCO2的平均反应速率v(CO2)=____。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是 (填序号)。
A.增加CO的量 B.加入催化剂
C.降低温度 D.扩大容积体积
(4)通过NOx传感器可监测NOx的含量,其工作原理如图所示,

则:
①Pt电极上发生的是 反应(填“氧化”或“还原”);
②NiO电极上的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com