
【题目】某高聚物的单体A(C11H12O2)可发生以下变化:

已知: C的烃基部分被取代生成的一氯代物D有两种;F的分子式为C7H8O,含有苯环,但与FeCl3溶液不显色。请回答:
(1)F分子中含有的官能团结构简式是 。
(2)由A生成B和F的反应类型为(选填序号) 。
①氧化反应 ②取代反应 ③水解反应 ④消去反应
(3)B的结构简式是 。
(4)分子式为C7H8O,含有苯环的同分异构体除F外还有 种。
(5)写出下列方程式
① 由A生成B和F: ;
② B → C: ;
③A在一定条件下生成高聚物: 。
【答案】(1) -OH (2) ②③ (3)CH2=C(CH3)COOH
(4)4种
(5)①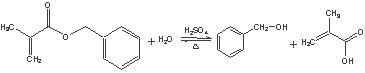
②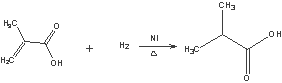
③n![]()
![]()
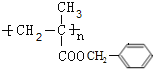 ,
,
【解析】
试题分析:F的分子式为C7H8O,含有苯环,但与FeCl3溶液不显色,说明F不含酚羟基,F能连续发生氧化反应,说明F含有醇羟基,故F为![]() ,则G为
,则G为![]() ,H为
,H为![]() .A在酸性条件下水解生成F与B,结合A的分子式可知,A含有1个酯基,故B的分子式为C4H6O2,含有1个羧基,A的不饱和度为(2×11+2-12)/2=6,则B分子中还存在碳碳双键,B与氢气发生加成反应生成C,C的烃基部分被取代生成的一氯代物D有两种,则C为(CH3)2CHCOOH,B为CH2=C(CH3)COOH,故A为
.A在酸性条件下水解生成F与B,结合A的分子式可知,A含有1个酯基,故B的分子式为C4H6O2,含有1个羧基,A的不饱和度为(2×11+2-12)/2=6,则B分子中还存在碳碳双键,B与氢气发生加成反应生成C,C的烃基部分被取代生成的一氯代物D有两种,则C为(CH3)2CHCOOH,B为CH2=C(CH3)COOH,故A为![]() ,A发生加聚反应生成高聚物为
,A发生加聚反应生成高聚物为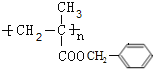 ,C与氢氧化钠反应生成E为(CH3)2CHCOONa,C与氯气发生取代反应生成D为(CH3)2CH(Cl)COOH或ClCH2CH(CH3)COOH,
,C与氢氧化钠反应生成E为(CH3)2CHCOONa,C与氯气发生取代反应生成D为(CH3)2CH(Cl)COOH或ClCH2CH(CH3)COOH,
(1)F为![]() ,分子中含有的官能团结构简式是:-OH,故答案为:-OH,故答案为:-OH;
,分子中含有的官能团结构简式是:-OH,故答案为:-OH,故答案为:-OH;
(2)由A生成B和F发生酯的水解反应,也属于取代反应,故答案为:②③,故答案为:②③;
(3)由上述分析可知,B的结构简式是CH2=C(CH3)COOH,故答案为:CH2=C(CH3)COOH;
(4)分子式为C7H8O,含有苯环的同分异构体除F(![]() ),可以有一个侧链为-OCH3,可以有2个侧链为-OH、-CH3,有邻、间、对三种位置,符合条件的同分异构体共有4种,故答案为:4;
),可以有一个侧链为-OCH3,可以有2个侧链为-OH、-CH3,有邻、间、对三种位置,符合条件的同分异构体共有4种,故答案为:4;
(5)①由A生成B和F的方程式为: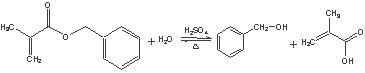 ②B→C的化学方程式为:CH2=C(CH3)COOH+H2
②B→C的化学方程式为:CH2=C(CH3)COOH+H2![]() (CH3)2CHCOOH;
(CH3)2CHCOOH;
③A在一定条件下生成高聚物的方程式为:n![]()
![]()
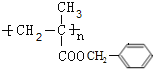 ,
,


科目:高中化学 来源: 题型:
【题目】氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气燃烧热值高。实验测得,在常温常压下,1 g H2完全燃烧生成液态水,放出142.9 kJ热量。则H2燃烧的热化学方程式为__________________________________。
(2)氢氧燃料电池能量转化率高,具有广阔的发展前景。现氢氧燃料电池进行下图所示实验:①氢氧燃料电池中,正极的电极反应式为_____ _。

②如图装置中,某一铜电极的质量减轻3.2 g,则a极上消耗的O2在标准状况下的体积为____________L
(3)氢气是合成氨的重要原料,合成氨反应的热化方程式如下:N2(g)+3H2(g)![]() 2NH3(g);ΔH=-92.4 kJ/mol①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),
2NH3(g);ΔH=-92.4 kJ/mol①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),
反应速率与时间的关系如下图所示。

图中t1时引起平衡移动的条件可能是__________其中表示平衡混合物中NH3的含量最高的一段时间是_____
②温度为T ℃时,将2 a mol H2和a mol N2放入0.5 L密闭容器中,充分反应
后测得N2的转化率为50%。则反应的平衡常数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M叫假蜜环菌甲素(如右图), 它是香豆素类天然化合物。对M性质叙述正确的是
它是香豆素类天然化合物。对M性质叙述正确的是
A. M能与FeCl3发生反应,不能与CH3COOH发生反应
B. M与Br2只能发生取代反应,不能发生加成反应
C. 1molM最多可消阿耗3mol NaOH
D. 1molM在催化剂作用下最多能与4molH2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应A+3B ![]() 2C+2D在四种不同情况下的反应速率分别为:
2C+2D在四种不同情况下的反应速率分别为:
①v(A)=0.15 mol·L-1·s-1;
②v(B)=0.6 mol·L-1·s-1;
③v(C)=0.4 mol·L-1·s-1;
④v(D)=0.45 mol·L-1·s-1。
该反应进行的快慢顺序为________________。
(2)在密闭容器中进行可逆反应,A与B反应生成C,其反应速率分别为:v1、v2、v3(mol·L-1·s-1),且v1、v2、v3之间有如下关系:v2=3v1,v3=2v1,则此反应的化学方程式表示为_________________。
(3)下列各项可以证明2HI(g) ![]() H2(g)+I2(g)已经达到平衡状态的是________。
H2(g)+I2(g)已经达到平衡状态的是________。
①单位时间内生成n mol I2的同时生成n mol HI;
②一个H—H键断裂的同时有两个H—I键断裂;
③百分组成ω(HI)=ω(H2)时;
④反应速率v(H2)=v(I2)=v(HI)/2时;
⑤c(H2):c(I2) :c(HI)=1:1:2时;
⑥温度和体积一定,容器内压强不再变化时;
⑦温度和压强一定,混合气体的密度不再变化时;
⑧温度和体积一定,混合气体的颜色不再变化时。
(4)已知反应2HI(g) = H2(g)+I2(g) ΔH=11 kJ·mol-1,1 mol H2(g)、1 mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为______kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在国民经济中占有重要地位。
(1)NH3的电子式为
(2)实验室中制取氨气的化学方程式为 ,生成的气体可以用蘸有浓盐酸的玻璃棒来检验,将产物溶于水,溶液呈酸性,用离子方程式表示原因 ;
溶液中离子浓度由大到小的顺序为
(3)欲快速制取氨气,可将浓氨水滴入固体氢氧化钠中,其装置如图,请结合化学用语从化学平衡的角度解释:

(4)将SO2气体通入氯化钡溶液,未见有沉淀生成,继续通入NH3,则出现白色沉淀,请写出反应的离子方程式 ;若将SO2气体通入酸化的硝酸钡溶液,也产生白色沉淀,用离子方程式加以说明 。
(5)氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
肼——空气燃料电池是一种碱性电池,该电池放电时,负极的反应式 。
(6)氮氧化物的排放会对空气造成污染,利用氧化法除去烟气中的氮氧化物。首先向氮氧化物中补充氧气,然后将混合气体通入石灰乳中,使之转化为硝酸钙。已知某氮氧化物由NO和NO2组成,且n(NO):n(NO2)=1:3.写出氧化吸收法除去氮氧化物的化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。

(1)向苦卤中通入Cl2是为了提取溴,发生反应的离子方程式为____。
(2)富集溴一般先用空气和水蒸气吹出单质溴,再用SO2的水溶液将其还原吸收,发生反应的化学方程式为____。也可用纯碱吸收溴,主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),吸收1 mol Br2时,转移的电子为____mol。
(3)下列有关海水综合利用的说法错误的是____。
A.粗盐可采用除杂和重结晶等过程提纯
B.电解饱和食盐水可制得金属钠
C.工业生产常选用NaOH作为沉淀剂
D.海水提镁涉及到复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)常温下,现有A、B、C、D四种电解质分别完全溶于水,所得四种溶液中含H+、Ba2+、Al3+、Na+、HCO3-、Cl-、OH-、SO42-八种离子(不考虑水解)。为了检验这四种物质,进行如下实验:
①取少量A的溶液分别与另三种物质反应,依次观察到:白色沉淀和气体、气体、白色沉淀。
②经测定,A和D的溶液显碱性,B和C的溶液pH<7。B与D的溶液反应产生两种沉淀,当D的量增大时,其中一种沉淀不断溶解,最终还存在一种沉淀。
③C与D的溶液反应,无明显现象。经测定,该反应的产物总能量小于反应物总能量。
根据上述实验事实,请回答下列问题:
(1)C的名称是________,D的化学式_________。
(2)用离子方程式表示A的溶液显碱性的原因:_________________。
(3)A与B在溶液中反应的离子方程式为________________。
(4)等物质的量浓度、等体积的B和D的溶液混合,写出反应的离子方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关NaClO和NaCl混合溶液的叙述正确的是( )
A. 该溶液中,H+、NH![]() 、SO
、SO![]() 、Br-可以大量共存
、Br-可以大量共存
B. 该溶液中,Ag+、K+、NO![]() 、CH3CHO可以大量共存
、CH3CHO可以大量共存
C. 向该溶液中滴入少量FeSO4溶液,反应的离子方程式:2Fe2++ClO-+2H+===Cl-+2Fe3++H2O
D. 向该溶液中加入浓盐酸,每产生1 molCl2,转移电子约为6.02×1023个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】置换反应的通式可表示为:

单质甲、乙和化合物A、B为中学常见物质,请回答下列问题:
(1)若单质乙为植物光合作用的产物,则该反应的化学方程式为 。
(2)若单质甲和化合物B均具有磁性,则该反应的化学方程式为 。
(3)若化合物A是红棕色粉末状固体,化合物B是一种既可以与强酸溶液反应又可以与强碱溶液反应的氧化物,则该反应的化学方程式为 。
(4)工业上利用置换反应原理制备一种半导体材料,写出该反应的化学方程式 。
(5)若单质乙是黑色非金属固体单质,化合物B是一种金属氧化物,常用作耐高温材料,则该反应的化学方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com