
【题目】G是具有抗菌作用的白头翁素衍生物,其合成路线如下:

(1)C中官能团的名称为________和________。
(2)E→F的反应类型为________。
(3)D→E的反应有副产物X(分子式为C9H7O2I)生成,写出X的结构简式:________________。
(4) F的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:__________________。
①能发生银镜反应;
②碱性水解后酸化,其中一种产物能与FeCl3溶液发生显色反应;
③分子中有4种不同化学环境的氢。
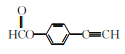
(5)请写出以乙醇为原料制备![]() 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。____________
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。____________
【答案】酯基 碳碳双键 消去反应 ![]()
 CH3CH2OH
CH3CH2OH![]() CH3CHO
CH3CHO
CH3CH2OH![]() CH3CH2Br
CH3CH2Br![]() CH3CH2MgBr
CH3CH2MgBr![]() CH3CH=CHCH3
CH3CH=CHCH3![]()
![]()
【解析】
(1)根据C的结构简式分析判断官能团;
(2)根据E、F的结构简式和结构中化学键的变化分析判断有机反应类型;
(3)根据D(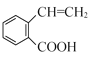 )中碳碳双键断键后的连接方式分析判断;
)中碳碳双键断键后的连接方式分析判断;
(4)根据题给信息分析结构中的官能团的类别和构型;
(5)结合本题中合成流程中的路线分析,乙醇在铜作催化剂加热条件下与氧气发生催化氧化生成乙醛,乙醇和溴化氢在加热条件下反应生成溴乙烷,溴乙烷在乙醚作催化剂与Mg发生反应生成CH3CH2MgBr,CH3CH2MgBr与乙醛反应后在进行酸化,生成CH3CH=CHCH3,CH3CH=CHCH3在加热条件下断开双键结合生成![]() 。
。
(1)C的结构简式为![]() ,其中官能团的名称为酯基和碳碳双键;
,其中官能团的名称为酯基和碳碳双键;
(2)根据E、F的结构简式,E中的一个I原子H原子消去形成一个碳碳双键生成E,属于卤代烃在氢氧化钠水溶液中发生的消去反应,则反应类型为消去反应;
(3)D→E的反应还可以由D( )中碳碳双键中顶端的碳原子与羧基中的氧形成一个六元环,得到副产物X(分子式为C9H7O2I),则 X的结构简式
)中碳碳双键中顶端的碳原子与羧基中的氧形成一个六元环,得到副产物X(分子式为C9H7O2I),则 X的结构简式![]() ;
;
(4)F的结构简式为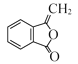 ,其同分异构体能发生银镜反应,说明结构中含有醛基;碱性水解后酸化,其中一种产物能与FeCl3溶液发生显色反应,说明分子结构中含有苯环和酯基,且该酯基水解后形成酚羟基;分子中有4种不同化学环境的氢原子,该同分异构体的结构简式为:
,其同分异构体能发生银镜反应,说明结构中含有醛基;碱性水解后酸化,其中一种产物能与FeCl3溶液发生显色反应,说明分子结构中含有苯环和酯基,且该酯基水解后形成酚羟基;分子中有4种不同化学环境的氢原子,该同分异构体的结构简式为: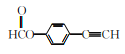 ;
;
(5)乙醇在铜作催化剂加热条件下与氧气发生催化氧化生成乙醛,乙醇和溴化氢在加热条件下反应生成溴乙烷,溴乙烷在乙醚作催化剂与Mg发生反应生成CH3CH2MgBr,CH3CH2MgBr与乙醛反应后在进行酸化,生成CH3CH=CHCH3,CH3CH=CHCH3在加热条件下断开双键结合生成![]() ,合成路线流程图为:CH3CH2OH
,合成路线流程图为:CH3CH2OH![]() CH3CHO
CH3CHO
CH3CH2OH![]() CH3CH2Br
CH3CH2Br![]() CH3CH2MgBr
CH3CH2MgBr![]() CH3CH=CHCH3
CH3CH=CHCH3![]()
![]() 。
。


科目:高中化学 来源: 题型:
【题目】“中和滴定”原理在实际生产生活中应用广泛。用I2O5可定量测定CO的含量,该反应原理为5CO+I2O5![]() 5CO2+I2。其实验步骤如下:
5CO2+I2。其实验步骤如下:
①取250 mL(标准状况)含有CO的某气体样品,通过盛有足量I2O5的干燥管,在170 ℃下充分反应;
②用水-乙醇混合溶液充分溶解产物I2,配制100 mL溶液;
③量取步骤②中溶液25.00 mL于锥形瓶中,然后用0.01 mol·L-1的Na2S2O3标准溶液滴定。
(1)步骤②中配制100 mL待测溶液需要用到的玻璃仪器的名称是烧杯、量筒、玻璃棒、胶头滴管和____________________。
(2)Na2S2O3标准液应装在__________(填字母)中。

(3)指示剂应选用__________,判断达到滴定终点的现象是____________。(已知:气体样品中其他成分不与I2O5反应:2Na2S2O3+I2=2NaI+Na2S4O6)。
(4)下列操作会造成所测CO的体积分数偏大的是________(填字母)。
a.滴定终点俯视读数
b.锥形瓶用待测溶液润洗
c.滴定前有气泡,滴定后没有气泡
d.配制100 mL待测溶液时,有少量溅出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.10mol·L-1的NaOH溶液滴加到10.00mL0.10mol·L-1HX溶液中,所得滴定曲线如图,已知HX的电离平衡常数为1.0×10-9,下列说法错误的是( )

A.①处pH约为5
B.②处pH一定大于7
C.水的电离程度:③>纯水>②
D.②中离子浓度大小关系:c(Na+)>c(X-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅晶体是立体的网状结构,其结构如图所示.关于二氧化硅晶体的下列说法不正确的是( )
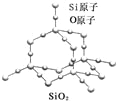
A. 晶体中Si、O原子个数比为1:2
B. 晶体中Si、O原子最外层都满足8电子结构
C. 晶体中一个硅原子含有Si﹣O键数目为4
D. 晶体中最小环上的原子数为6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍是一种用途广泛的金属,常用于电镀工业和制造电池。镍易形成Ni(CO)4、[Ni(NH3)6]SO4等配合物。
(1)镍基态原子的核外电子排布式为________。
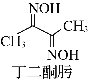
(2)Ni2+可用丁二酮肟检验。丁二酮肟的结构如图所示,其分子中碳原子轨道的杂化类型为________。
(3)与CO互为等电子体的阴离子的化学式为__________________。
(4)1 mol [Ni(NH3)6]SO4中σ键的数目为________。氨的沸点高于膦(PH3),原因是____________________________。
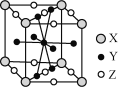
(5)镧镍合金是较好的储氢材料。储氢后所得晶体的化学式为LaNi5H6,晶胞结构如图所示,X、Y、Z表示储氢后的三种微粒,则图中Z表示的微粒为________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳钢广泛应用在石油化工设备管道等领域,随着深层石油天然气的开采,石油和天然气中含有的CO2及水引起的腐蚀问题(俗称二氧化碳腐蚀)引起了广泛关注。深井中二氧化碳腐蚀的主要过程如下所示:
负极:![]() (主要)
(主要)
正极:![]() (主要)
(主要)
下列说法不正确的是
A.钢铁在CO2水溶液中的腐蚀总反应可表示为![]()
B.深井中二氧化碳对碳钢的腐蚀主要为化学腐蚀
C.碳钢管道在深井中的腐蚀与油气层中盐份含量有关,盐份含量高腐蚀速率会加快
D.腐蚀过程表明含有CO2的溶液其腐蚀性比相同pH值的HCl溶液腐蚀性更强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列说法不正确的是( )
A.电解精炼铜时,若阳极质量减少64 g,则转移到阴极的电子数不一定等于2NA
B.18 g氨基(-ND2)中含有的电子数为10NA
C.用惰性电极电解100 mL 0.1 mol·L-1的CuSO4溶液,当阴、阳两极产生相同条件下等体积的气体时,电路中转移电子数为0. 04NA
D.工业合成氨每断裂NA个N≡N键,同时断裂6NA个N-H键,则反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛分子的结构式如图所示,下列描述正确的是( )
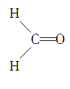
A. 甲醛分子中有4个σ键
B. 甲醛分子中的C原子为sp3杂化
C. 甲醛分子中的O原子为sp杂化
D. 甲醛分子为平面三角形,有一个π键垂直于三角形平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现Pd2团簇可催化CO的氧化,在催化过程中路径不同可能生成不同的过渡态和中间产物(过渡态已标出),下图为路径1和路径2催化的能量变化。下列说法错误的是

A.CO的催化氧化反应为2CO+O2=2CO2
B.反应路径1的催化效果更好
C.路径1和路径2第一步能量变化都为3.22 eV
D.路径 1 中最大能垒(活化能)E正 =1.77 eV
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com