
【题目】镍是一种用途广泛的金属,常用于电镀工业和制造电池。镍易形成Ni(CO)4、[Ni(NH3)6]SO4等配合物。
(1)镍基态原子的核外电子排布式为________。
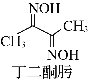
(2)Ni2+可用丁二酮肟检验。丁二酮肟的结构如图所示,其分子中碳原子轨道的杂化类型为________。
(3)与CO互为等电子体的阴离子的化学式为__________________。
(4)1 mol [Ni(NH3)6]SO4中σ键的数目为________。氨的沸点高于膦(PH3),原因是____________________________。
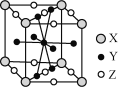
(5)镧镍合金是较好的储氢材料。储氢后所得晶体的化学式为LaNi5H6,晶胞结构如图所示,X、Y、Z表示储氢后的三种微粒,则图中Z表示的微粒为________(填化学式)。
【答案】[Ar]3d84s2(或1s22s22p63s23p63d84s2) sp3、sp2 CN- 28 mol NH3分子间可形成氢键,而PH3分子间不能 H2
【解析】
(1)镍在元素周期表中的原子序数为28,根据原子的构造原理书写;
(2)根据结构简式中碳原子的键连方式分析;
(3)等电子体是指一类分子或离子,组成它们的原子数相同,而且所含的价层电子数相同;
(4) [Ni(NH3)6]SO4中的配位键和单键都为σ键。PH3分子之间为范德华力,氨气分子之间形成氢键,增大了物质的沸点;
(5)根据均摊法计算晶胞中各微粒的数目,进而分析判断X、Y、Z代表的微粒。
(1)镍在元素周期表中的原子序数为28,根据原子的构造原理,镍基态原子的核外电子排布式为[Ar]3d84s2(或1s22s22p63s23p63d84s2);
(2)根据丁二酮肟的结构简式,其中中碳原子既有单键又有双键,碳碳单键上的碳原子的杂化类型是sp2,碳碳双键上的碳原子的杂化类型是sp3杂化;
(3)等电子体是指一类分子或离子,组成它们的原子数相同,而且所含的价层电子数相同,CO含有2个原子,价层电子数为14个电子,与CO互为等电子体的阴离子有 CN-或C22-等;
(4) [Ni(NH3)6]SO4中Ni2+与6个NH3形成6个配位键属于σ键,NH3形成3个氮氢单键为σ键,SO42-中含有4个σ键,所以1 mol [Ni(NH3)6]SO4中σ键的数目=1 mol×(6+6×3+4)=28mol; PH3分子之间为范德华力,氨气分子之间形成氢键,分子间作用力更强,增大了物质的沸点,故氨气的沸点高于PH3分子的;
(5)晶胞中X位于晶胞的顶点,数目=8×![]() =1、Y位于晶胞的体心和面上,数目=1+8×
=1、Y位于晶胞的体心和面上,数目=1+8×![]() =5、Z位于晶胞的面和棱上,数目=8×
=5、Z位于晶胞的面和棱上,数目=8×![]() +2×
+2×![]() =3,则该物质的组成为XY5Z3,结合化学式LaNi5H6,可知X代表La、Y代表Ni、Z代表H2。
=3,则该物质的组成为XY5Z3,结合化学式LaNi5H6,可知X代表La、Y代表Ni、Z代表H2。


科目:高中化学 来源: 题型:
【题目】在温热气候条件下,浅海地区有厚层的石灰石沉积,而深海地区却很少。下列解析不正确的是
A. 与深海地区相比,浅海地区水温较高,有利于游离的CO2增多、石灰石沉积
B. 与浅海地区相比,深海地区压强大,石灰石岩层易被CO2溶解,沉积少
C. 深海地区石灰石岩层的溶解反应为:CaCO3(s)+H2O(l)+CO2(aq)Ca(HCO3)2(aq)
D. 海水呈弱酸性,大气中CO2浓度增加,会导致海水中CO![]() 浓度增大
浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对甲基苯乙酮是重要的化工原料,某实验小组利用如图装置制备对甲基苯乙酮。

制备原理: (放热反应)。 反应物和产物的相关数据列表:
(放热反应)。 反应物和产物的相关数据列表:
试剂名称 | 分子式 | 分子量 | 熔点/℃ | 沸点/℃ | 密度/g·mL-1 |
甲苯 | C7H8 | 92 | -93 | 110.6 | 0.8669 |
乙酸酐 | (CH3CO)2 | 102 | -73.1 | 138.6 | 1.08 |
对甲基苯乙酮 | C9H10O | 134 | 28 | 94(0.93kPa) | 1.0051 |
实验步骤:
步骤 1:如图所示,在 100mL 三颈烧瓶上安装搅拌器、仪器 x 和上口装有无水氯化钙的冷凝管,干燥管与一气体 吸收装置相连。
步骤 2:三颈烧瓶中快速加入研碎的催化剂和 20mL 无水甲苯,在搅拌的条件下通过仪器 x 缓慢地滴加 3.4mL 醋酸酐与 5mL 甲苯的混合液,约需 15min 滴完。
步骤 3:反应结束后,将三颈烧瓶在 95℃时加热 25~30min。
步骤 4:反应混合液冷却后转移到盛有 30mL 浓盐酸与 30mL 冰水的烧杯中(目的是将对甲基苯乙酮从其与铝的化 合物中分离出来),用分液漏斗分出有机层、水层。每次用 5mL 甲苯萃取两次,并将所有甲苯层合并,然后依次 用水、10%氢氧化钠溶液、水各 10mL 洗涤有机层,最后用无水硫酸镁处理。
步骤 5:将干燥后的溶液滤入蒸馏瓶,减压蒸馏(整套装置必须是干燥的),收集 94℃(0.93kPa)馏分,得到对甲 基苯乙酮 4.1g。
请回答下列问题:
(1)仪器 x 的名称为________。与普通的分液漏斗相比,本实验采用仪器 x 的优点为_______。
(2)本实验中的氯化铝若水解则会影响催化效率,除了使用干燥管的措施外,还应该采取哪些措施防止水解_____(答两点)。
(3)步骤③中最适宜的加热方式为 _____。
(4)步骤④中加入 10%的氢氧化钠溶液的目的为 _____,加入无水硫酸镁的目的为_________。
(5)步骤④中水层每次用 5mL 甲苯萃取两次并将所有甲苯层合并的目的为________。
(6)步骤⑤中减压蒸馏时所需的冷凝装置能否选用题给装置图中的球形冷能管_____(答“能”或“不能”)。 本实验中,对甲基苯乙酮的产率为_____(结果保留 2 位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是
A.用向上排空气法收集NO
B.用装置甲配制100 mL 0.100 mol·L-1的硫酸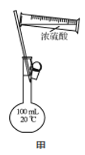
C.用装置乙蒸发CuCl2溶液可得到CuCl2固体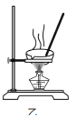
D.向含少量水的乙醇中加入生石灰后蒸馏可得到无水乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,将SO2通入NaOH溶液得到一组c(H2SO3)+c(HSO3-)+c(SO32-)=0.100 mol·L-1的混合溶液,溶液中部分微粒的物质的量浓度随pH的关系曲线如右下图所示。下列叙述正确的是
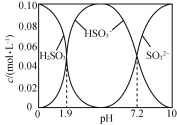
A.H2SO3的Ka2=10-7.2
B.pH=1.9的溶液中:c(Na+)>c(H2SO3)=c(HSO3-)> c(SO32-)
C.c(Na+)=0.100 mol·L-1的溶液中:c(H+)+c(SO32-)=c(OH-)+c(H2SO3)
D.c(HSO3-)=0.050 mol·L-1的溶液中:c(H+)+c(Na+)<0.150 mol·L-1+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是具有抗菌作用的白头翁素衍生物,其合成路线如下:

(1)C中官能团的名称为________和________。
(2)E→F的反应类型为________。
(3)D→E的反应有副产物X(分子式为C9H7O2I)生成,写出X的结构简式:________________。
(4) F的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:__________________。
①能发生银镜反应;
②碱性水解后酸化,其中一种产物能与FeCl3溶液发生显色反应;
③分子中有4种不同化学环境的氢。
(5)请写出以乙醇为原料制备![]() 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。____________
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的单质、氧化物、盐在现代T业中有着重要用途。
I.(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2、还有组成类似Fe3O4的PbO2。请将Pb3O4改写成简单氧化物的形式: ___。
Ⅱ.以废旧铅酸电池中的含铅废料铅膏(Pb、PbO、PbO2、PbSO4等)为原料,制备超细PbO,实现铅的再生利用。其工作流程如下:
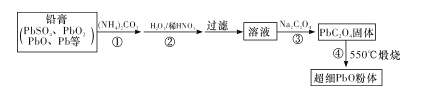
(2)步骤①的目的是“脱硫”,即将PbSO4转化为PbCO3,反应的离子方程式为____。 “脱硫过程”可在如图所示的装置中进行。实验条件为:转化温度为35℃,液固比为5:1,转化时间为2h。
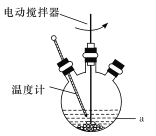
①仪器a的名称是____;转化温度为35℃,采用的合适加热方式是____。
②步骤②中H2O2的作用是____(用化学方程式表示)。
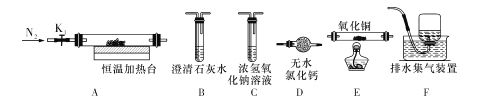
(3)草酸铅受热分解生成PbO时,还有CO和CO2生成,为检验这两种气体,用下图所示的装置(可重复选用)进行实验。实验装置中,依次连接的合理顺序为A ___(填装置字母代号),证明产物中有CO气体的实验现象是____。
(4)测定草酸铅样品纯度:称取2.5 g样品,酸溶后配制成250 mL溶液,然后量取25. 00 mL该溶液,用0. 050 00 mol/L的EDTA( Na2H2Y)标准溶液滴定其中的Pb2+(反应方程式为____,杂质不反应),平行滴定三次,平均消耗EDTA标准溶液14. 52 mL。
①若滴定管未用EDTA标准液润洗,测定结果将 ___(填“偏高”“偏低”或“不变”)。
②草酸铅的纯度为 ___(保留四位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,原子核外p能级、d能级等原子轨道上电子排布为“全空”、“半充满”、“全充满”时更加稳定,称为洪特规则的特例,下列事实能作为这个规则证据的是( )
①元素氦(He)的第一电离能远大于元素氢(H)的第一电离能
②![]() 容易失去电子转变为
容易失去电子转变为![]() ,表现出较强的还原性
,表现出较强的还原性
③基态铜(Cu)原子的电子排布式为![]() 而不是
而不是![]()
④某种激发态碳(C)原子的电子排布式为![]() 而不是
而不是![]()
A.①③B.②③C.③④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活社会密切相关。下列说法正确的是
A.一次性医用外科口罩的核心功能层熔喷布以纯净物聚丙烯为主要原料制成
B.在“新冠肺炎战疫”中,将84消毒液和医用酒精混合使用,消毒效果更佳
C.绿色化学的核心是从源头上减少和消除化工生产对环境的污染
D.纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子较强的物理吸附
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com