
【题目】下列实验操作能达到实验目的的是
A.用向上排空气法收集NO
B.用装置甲配制100 mL 0.100 mol·L-1的硫酸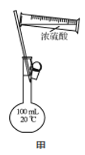
C.用装置乙蒸发CuCl2溶液可得到CuCl2固体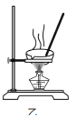
D.向含少量水的乙醇中加入生石灰后蒸馏可得到无水乙醇
【答案】D
【解析】
A.NO能与空气中的氧气反应,不能使用排空气法收集,NO难溶于水,应使用排水法收集NO,故A错误;
B.容量瓶是用来配制一定体积、一定物质的量浓度溶液的定量仪器,瓶上标有刻度、并标有容量;容量瓶对溶液的体积精确度要求较高,只能在常温下使用,瓶上标有使用温度,一般为25℃,浓硫酸稀释放热,应该在烧杯中进行,所以不能将浓硫酸直接在容量瓶中稀释,故B错误;
C.CuCl2溶液中存在水解平衡,加热蒸干氯化铜溶液,Cu2++2H2OCu(OH)2↓+2H+,水解生成的氯化氢在加热过程中挥发,蒸干得到水解产物氢氧化铜,故C错误;
D.氧化钙与水反应生成难挥发的氢氧化钙,能消耗乙醇中的水,乙醇易挥发,然后蒸馏即可得到乙醇,故D正确;
答案选D。


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是_______________(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol/L NH4Al(SO4)2中的c(NH![]() )________(填“等于”“大于”或“小于”)0.1 mol/L NH4HSO4中的c(NH
)________(填“等于”“大于”或“小于”)0.1 mol/L NH4HSO4中的c(NH![]() )。
)。
(3)如图是0.1 mol/L电解质溶液的pH随温度变化的图像。

①其中符合0.1 mol/L NH4Al(SO4)2的pH随温度变化的曲线是________(填写字母),导致pH随温度变化的原因是___________________;
②20℃时,0.1 mol/L NH4Al(SO4)2中2c(SO![]() )-c(NH
)-c(NH![]() )-3c(Al3+)=________。
)-3c(Al3+)=________。
(4)室温时,向100 mL 0.1 mol/L NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:

试分析图中a、b、c、d四个点,水的电离程度最大的是________;在b点,溶液中各离子浓度由大到小的排列顺序是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向盛有 20 mL0.1mol·L-1 的 NaOH 溶液的绝热容器中加入 pH=2 的 HA 溶液,加入 HA 溶液的体积 V与所得混合溶液温度 T的关系如图所示。 下列说法错误的是

A.25℃时 pH=2 的 HA 溶液中 HA 的电离度约为 10%
B.M 点溶液中存在:c(Na+ ) > c(A-)> c(OH-)> c(H+)
C.P 点溶液中存在:3 c(Na+ )=2 c(HA)+ 2c(A-)
D.M→N→P 的过程中水的电离程度先增大后减小,M 点水电离程度小于 P 点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.10mol·L-1的NaOH溶液滴加到10.00mL0.10mol·L-1HX溶液中,所得滴定曲线如图,已知HX的电离平衡常数为1.0×10-9,下列说法错误的是( )

A.①处pH约为5
B.②处pH一定大于7
C.水的电离程度:③>纯水>②
D.②中离子浓度大小关系:c(Na+)>c(X-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以A、B、C为原料制取药物AspirinSustained-ReleaseTablets(缓释阿司匹林)的合成路线如图:

已知:ⅰ.A、B为烃,其中A的产量可作为石油化工水平的标志;
ⅱ. 。
。
回答下列问题:
(1)Z所含官能团名称为___。
(2)B和Y的结构简式为__、__。
(3)完成方程式:
①X→CH2OHCH2OH__。
②C→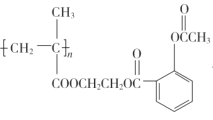 __。
__。
(4)满足以下条件的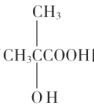 的同分异构体共有__种(不含立体异构),其中核磁共振氢谱峰面积比为6:1:1的同分异构体的结构简式为__。
的同分异构体共有__种(不含立体异构),其中核磁共振氢谱峰面积比为6:1:1的同分异构体的结构简式为__。
a.能发生水解反应 b.能与钠反应放出氢气 c.能发生银镜反应
(5)以乳酸(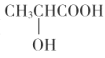 )和甲醇为原料,其他无机试剂任选,设计合成
)和甲醇为原料,其他无机试剂任选,设计合成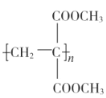 的路线:__。
的路线:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅晶体是立体的网状结构,其结构如图所示.关于二氧化硅晶体的下列说法不正确的是( )
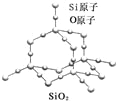
A. 晶体中Si、O原子个数比为1:2
B. 晶体中Si、O原子最外层都满足8电子结构
C. 晶体中一个硅原子含有Si﹣O键数目为4
D. 晶体中最小环上的原子数为6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍是一种用途广泛的金属,常用于电镀工业和制造电池。镍易形成Ni(CO)4、[Ni(NH3)6]SO4等配合物。
(1)镍基态原子的核外电子排布式为________。
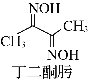
(2)Ni2+可用丁二酮肟检验。丁二酮肟的结构如图所示,其分子中碳原子轨道的杂化类型为________。
(3)与CO互为等电子体的阴离子的化学式为__________________。
(4)1 mol [Ni(NH3)6]SO4中σ键的数目为________。氨的沸点高于膦(PH3),原因是____________________________。
(5)镧镍合金是较好的储氢材料。储氢后所得晶体的化学式为LaNi5H6,晶胞结构如图所示,X、Y、Z表示储氢后的三种微粒,则图中Z表示的微粒为________(填化学式)。
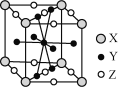
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列说法不正确的是( )
A.电解精炼铜时,若阳极质量减少64 g,则转移到阴极的电子数不一定等于2NA
B.18 g氨基(-ND2)中含有的电子数为10NA
C.用惰性电极电解100 mL 0.1 mol·L-1的CuSO4溶液,当阴、阳两极产生相同条件下等体积的气体时,电路中转移电子数为0. 04NA
D.工业合成氨每断裂NA个N≡N键,同时断裂6NA个N-H键,则反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是四种原子序数依次增大的短周期元素,W的最外层电子数比X的最外层电子数少1个,X、Y、Z为同一周期元素,X、Y、Z组成一种化合物(ZXY)2的结构式如图所示。下列说法错误的是
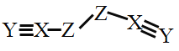
A.化合物WY是良好的耐热冲击材料
B.Y的氧化物对应的水化物可能是弱酸
C.X的氢化物的沸点一定小于Z的
D.化合物(ZXY)2中所有原子均满足8电子稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com