
【题目】常温下,浓度均为0.1mol·L-1、体积为V0的HX、HY溶液,分别加水稀释至体积V,pH随lg ![]() 的变化关系如图所示。下列叙述正确的是( )
的变化关系如图所示。下列叙述正确的是( )

A.HX、HY都是弱酸,且HX的酸性比HY的弱
B.常温下,由水电离出的c(H+)·c(OH-):a<b
C.相同温度下,电离常数K(HX):a>b
D.lg ![]() =3,若同时微热两种溶液,则
=3,若同时微热两种溶液,则![]() 减小
减小
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案科目:高中化学 来源: 题型:
【题目】二甲醚是重要的有机中间体,利用二氧化碳加氢合成二甲醚能变废为宝,且可替代汽油作为新型清洁燃料。常温常压下,二氧化碳加氢可选择性生成二甲醚或一氧化碳:
①CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H1=﹣55.7kJ/mol
②2CH3OH(l)═CH3OCH3(g)+H2O(l)△H2=﹣23.4kJ/mol
③CO2(g)+H2(g)═CO(g)+H2O(l) △H3
④H2O(l)=H2O(g) △H4=+44.0kJ/mol
(1)已知反应CO2(g)+H2(g)=CO(g)+H2O(g)△H,中相关的化学键键能数据如下:

由此计算△H=______,则△H3=_______。
(2)CO2(g)加氢转化为CH3OCH3(g)和H2O(l)的热化学方程式是___。
(3)合成二甲醚往往选用硅铝混合物作催化剂,硅铝比例不同,生成二甲醚或一氧化碳的物质的量分数不同。硅铝比与产物选择性如图所示,图中A点和B点的平衡常数比较:KA___KB(填“>、=、<”)。根据以上两条曲线,写出其中一条变化规律:a.___。b.___。
(4)常温常压下,向一个2.00L的密闭恒容容器中加入等量2.00mol二氧化碳和氢气,平衡时二甲醚的浓度为0.150mol/L,计算此时二氧化碳的转化率及该反应的平衡常数,要求写出计算过程(计算结果保留3位有效数字)________、_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为前四周期原子序数依次增大的五种元素。A原子半径是周期表中原子半径最小的;B可以和A形成两种常见的液态化合物甲和乙,且原子个数之比分别是1:1和1:2;C、 D为同周期元素,C是所属周期的主族元素中电负性最小的;D的单质晶体是分子晶体,原子最外层有两个未成对电子;E位于周期表的ds区,E元素原子最外层有一个未成对电子。回答下列问题:
(1)E2+的简化电子排布式是__________;甲和乙沸点较高的是___________(填化学式);
(2)D与B形成常见的具有还原性的阴离子立体构型是三角锥形;则D显最高正价时与B形成的常见化合物的中心原子的杂化类型是_________
(3)同时由A、B、C、D四种元素组成的两种盐M和W,写出这两种盐溶液反应的离子方程式___________
(4)由B、D、E三种元素组成常见盐溶液丙,向丙溶液加入过量NaOH溶液可生成[E(OH)4]2-,不考虑空间构型,[E(OH)4]2-的结构可用示意图表示为__________
(5)根据周期表对角线规则,铍和铝的性质有相似性,则书写铍单质和C的最高正价氧化物对应水化物溶液发生反应的离子方程式是___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.pH=1的一元酸和pH=13的一元碱等体积混合后的溶液中,一定有:c(OH-)=c(H+)
B.可用纯碱溶液清洗油污其原因是:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
C.加热蒸干并灼烧AlCl3溶液得到Al(OH)3固体
D.常温下,Ksp(CaCO3)=2.8×10-9,Ksp(CaSO4)=9.1×10-6,在CaCO3的饱和溶液中加入Na2SO4,也可能产生CaSO4沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)实验室中常用NaOH溶液来进行洗气和提纯,当100mL![]() 的NaOH溶液吸收标准状况下
的NaOH溶液吸收标准状况下![]()
![]() 时,所得溶液中各离子浓度由大到小的顺序为______
时,所得溶液中各离子浓度由大到小的顺序为______
(2)常温下向一定体积的![]() 醋酸溶液中加水稀释后,下列说法正确的是______.
醋酸溶液中加水稀释后,下列说法正确的是______.
A.溶液中导电粒子的数目减少 ![]() 醋酸的电离程度增大,
醋酸的电离程度增大,![]() 亦增大
亦增大
C.溶液中 不变
不变 ![]() 溶液中
溶液中 减小
减小
(3)①常温下将![]() 稀硫酸
稀硫酸![]() 与
与![]() NaOH溶液
NaOH溶液![]() mL棍合,所得溶液的pH为1,则
mL棍合,所得溶液的pH为1,则![]() :
:![]() ______
______![]() 溶液体积变化忽略不询.
溶液体积变化忽略不询.
②常温下若溶液由![]() 的HA溶液
的HA溶液![]() 与
与![]() 的NaOH溶液
的NaOH溶液![]() 混合而得,则下列说法正确的是______
混合而得,则下列说法正确的是______
A.若反应后溶液呈中性,则![]()
B.若![]() ,反应后溶液pH一定等于7
,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则![]() 一定大于
一定大于![]()
D.若反应后溶液呈碱性,则![]() 一定小于
一定小于![]()
(4)常温下,浓度均为![]() 的下列五种溶液的pH值如下表所示:
的下列五种溶液的pH值如下表所示:
溶质 |
|
|
| NaClO | NaCN |
pH |
|
|
|
|
|
①根据表中数据,将浓度均为![]() 的下列四种酸的溶液分别稀释100倍,pH变化最小的是______
的下列四种酸的溶液分别稀释100倍,pH变化最小的是______
A.HCN![]()
![]()
![]()
②根据以上数据,判断下列反应可以成立的是______.
A.![]()
![]()
C.![]()
![]()
(5)几种离子开始沉淀时的pH如下表:
离子 |
|
|
|
pH |
|
|
|
当向含相同浓度![]() 、
、![]() 、
、![]() 离子的溶液中滴加NaOH溶液时,______
离子的溶液中滴加NaOH溶液时,______![]() 填离子符号
填离子符号![]() 先沉淀,
先沉淀,![]() ______
______![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以环戊烷为原料制备环戊二烯的合成路线如图,则下列说法正确的是( )
![]()
A. A的结构简式是![]()
B. ①②的反应类型分别是取代、消去
C. 反应②③的条件分别是浓硫酸加热、光照
D. 加入酸性KMnO4溶液,若溶液褪色则可证明![]() 已完全转化为
已完全转化为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是反应A(g) + 3B(g) 2C(g) + 2D(g) 在四种不同情况下的反应速率,反应速率最大的是
A. υ(A)=0.45mol·L-1·s-1B. υ(B)=0.6mol·L-1·s-1
C. υ(C)=0.4mol·L-1·s-1D. υ(D)=0.45mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从铝土矿![]() 主要成分是
主要成分是![]() ,含
,含![]() 、
、![]() 、MgO等杂质
、MgO等杂质![]() 中提取氧化铝的两种工艺流程如下:
中提取氧化铝的两种工艺流程如下:
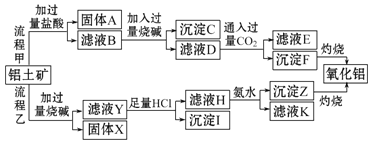
请回答下列问题:
![]() 固体A是______,沉淀F是______,沉淀I是______
固体A是______,沉淀F是______,沉淀I是______![]() 写出有关的化学式
写出有关的化学式![]()
![]() 流程甲中加入过量烧碱得到滤液D的离子方程式为______
流程甲中加入过量烧碱得到滤液D的离子方程式为______
![]() 流程乙加入烧碱有关的化学方程式为______、______
流程乙加入烧碱有关的化学方程式为______、______
![]() 流程乙中滤液H中加入氨水的有关离子方程式______
流程乙中滤液H中加入氨水的有关离子方程式______
![]() 滤液E中溶质的主要成分是___
滤液E中溶质的主要成分是___![]() 填化学式
填化学式![]() ,写出该溶质的一种用途______。
,写出该溶质的一种用途______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 肼(N2H4)具有强还原性,可用作火箭燃料、抗氧剂等。
(1)肼可以由氨气反应制得,已知部分化学键键能如下表所示:
化学键 | H—H | N≡N | N—H |
键能/kJ·molˉ1 | a | b | c |
①工业上合成氨的反应N2(g)+3H2(g)![]() 2NH3(g) ΔH=____ kJ·mol-1
2NH3(g) ΔH=____ kJ·mol-1
②合成氨反应的活化能很大,能加快反应速率但不改变反应活化能的方法是____。
(2)肼作火箭燃料与二氧化氮反应生成氮气和水。已知部分反应热化学方程式如下:
N2(g)+O2(g)=2NO(g) ΔH=+183 kJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=-116.2 kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
写出肼作火箭燃料时反应的热化学方程式____。
(3)肼-空气燃料电池是一种环保型燃料电池,结构如图所示;

①肼-空气燃料电池的负极反应式为____。
②全钒液流可充电电池结构如图所示,将肼-空气燃料电池的A极与全钒液流可充电电池的C极相连,B极与D极相连,写出阴极的电极反应式____。
(4)肼可用于处理高压锅炉水中的氧,防止锅炉被腐蚀。与使用Na2SO3处理水中溶解的O2相比,肼的优点是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com