
【题目】A、B、C、D、E为前四周期原子序数依次增大的五种元素。A原子半径是周期表中原子半径最小的;B可以和A形成两种常见的液态化合物甲和乙,且原子个数之比分别是1:1和1:2;C、 D为同周期元素,C是所属周期的主族元素中电负性最小的;D的单质晶体是分子晶体,原子最外层有两个未成对电子;E位于周期表的ds区,E元素原子最外层有一个未成对电子。回答下列问题:
(1)E2+的简化电子排布式是__________;甲和乙沸点较高的是___________(填化学式);
(2)D与B形成常见的具有还原性的阴离子立体构型是三角锥形;则D显最高正价时与B形成的常见化合物的中心原子的杂化类型是_________
(3)同时由A、B、C、D四种元素组成的两种盐M和W,写出这两种盐溶液反应的离子方程式___________
(4)由B、D、E三种元素组成常见盐溶液丙,向丙溶液加入过量NaOH溶液可生成[E(OH)4]2-,不考虑空间构型,[E(OH)4]2-的结构可用示意图表示为__________
(5)根据周期表对角线规则,铍和铝的性质有相似性,则书写铍单质和C的最高正价氧化物对应水化物溶液发生反应的离子方程式是___________________
【答案】[Ar] 3d9 H2O2 sp2 H+﹢HSO3-=H2O﹢SO2  Be+2OH-=BeO22-+H2↑
Be+2OH-=BeO22-+H2↑
【解析】
A、B、C、D、E为前四周期原子序数依次增大的五种元素。A原子半径是周期表中原子半径最小的,则A是H元素;B可以和A形成两种常见的液态化合物甲和乙,且原子个数之比分别是1:1和1:2;则B是O元素,形成的化合物甲是H2O2,乙是H2O;C、 D为同周期元素,C是所属周期的主族元素中电负性最小的,则C是Na元素;D的单质晶体是分子晶体,原子最外层有两个未成对电子,则D是S元素;E位于周期表的ds区,E元素原子最外层有一个未成对电子,则E是Cu元素。
(1)Cu2+的简化电子排布式是[Ar] 3d9;甲、乙分别是H2O2、H2O,由于二者都是分子晶体,分子之间的作用力越大,物质的熔沸点越高,所以沸点较高的是H2O2;
(2)D与B形成常见的具有还原性的阴离子SO32-立体构型是三角锥形;则D显最高正价时与B形成的常见化合物SO3的中心原子的杂化类型是杂化sp2 ;
(3)同时由A、B、C、D四种元素组成的两种盐M和W是NaHSO4、NaHSO3,前者是强酸的酸式盐,起一元强酸的作用,后者是强碱弱酸的酸式盐,二者发生反应产生硫酸钠、水和二氧化硫,这两种盐溶液反应的离子方程式是H+﹢HSO3-=H2O﹢SO2;
(4)由B、D、E三种元素组成常见盐溶液丙是CuSO4,向丙溶液加入过量NaOH溶液可生成[Cu(OH)4]2-,不考虑空间构型,[Cu(OH)4]2-的结构中Cu2+与4个OH-的氧原子之间通过配位键结合,可用示意图表示为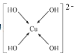 ;
;
(5)根据周期表对角线规则,铍和铝的性质有相似性,铍单质和C的最高正价氧化物对应水化物NaOH溶液发生反应,产生铍酸钠和氢气,反应的离子方程式是Be+2OH-=BeO22-+H2↑。


 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】2019年是元素周期表发表150周年,期间科学家为完善周期表做出了不懈努力。中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法不正确的是
A. In是第五周期第ⅢA族元素
B. 11549In的中子数与电子数的差值为17
C. 原子半径:In>Al
D. 碱性:In(OH)3>RbOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。放电时,该电池总反应式为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O。请根据上述情况判断:
2PbSO4+2H2O。请根据上述情况判断:
(1)该蓄电池的负极材料是_________,放电时发生_________(填“氧化”或“还原”)反应。
(2)该蓄电池放电时,电解质溶液的酸性_________(填“增大”、“减小”或“不变”)。
(3)已知硫酸铅为不溶于水的白色固体,生成时附着在电极上。试写出该电池放电时,正极的电极反应_______(用离子方程式表示)。
(4)氢氧燃料电池具有启动快、效率高等优点,其能量密度高于铅蓄电池。若电解质为H2SO4溶液,则氢氧燃料电池的正极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验现象,所得结论正确的是![]()
实验 | 实验现象 | 结论 |
A |
左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性: |
B |
左边棉花变为橙色,右边棉花变为蓝色 | 氧化性: |
C |
白色固体先变为淡黄色,后变为黑色 | 溶解性: |
D |
锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性: |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列溶液中微粒浓度关系一定正确的是( )
A.0.1mol·L-1Na2CO3溶液中,加水稀释,![]() 的值减小
的值减小
B.0.1mol·L-1的硫酸铝溶液中:c(SO42-)>c(Al3+)>c(H+)>c(OH-)
C.pH=7的氨水与氯化铵的混合溶液中:c(Cl-)>c(NH4+)
D.pH=2的醋酸溶液和pH=12的NaOH溶液等体积混合:c(Na+)=c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.浓度均为①![]() 的
的![]() ②
②![]() ③
③![]() ④
④![]() 溶液中
溶液中![]() 的大小顺序为③>①>②>④
的大小顺序为③>①>②>④
B.浓度均为![]() 的
的![]() 溶液与NaClO溶液,溶液中阴、阳离子的总浓度前者大于后者
溶液与NaClO溶液,溶液中阴、阳离子的总浓度前者大于后者
C.![]() 为一元弱酸,在
为一元弱酸,在![]() 水溶液中存在:
水溶液中存在:![]()
D.![]() 的
的![]() 溶液中:
溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B. 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C. pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D. 向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列关于该装置的说法错误的是

A.溶液中的![]() 移向电极Y
移向电极Y
B.若两电极分别为铁棒和碳棒,则X为铁棒且X为原电池的负极
C.X极上发生的是氧化反应,Y极上发生的还原是反应
D.若两电极都是金属,则它们的活动性顺序为X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)为紫黑色粉末,是一种新型高效消毒剂。K2FeO4易溶于水,微溶于浓KOH溶液,在0~5 ℃的强碱性溶液中较稳定。一般制备方法是先用Cl2与KOH溶液在20 ℃以下反应生成KClO(在较高温度下则生成KClO3),KClO再与KOH、Fe(NO3)3溶液反应即可制得K2FeO4。实验装置如图所示:

回答下列问题:
(1) 制备KClO。
①装置B的作用_______。
②装置C中三颈烧瓶置于冰水浴中的目的是________。
(2) 制备K2FeO4。
①装置C中得到足量KClO后,将三颈烧瓶上的导管取下,加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度,搅拌,当溶液变为紫红色,该反应的离子方程式为______。
②向装置C中加入饱和KOH溶液,析出紫黑色晶体,过滤。
(3) 测定K2FeO4纯度。
测定制备的K2FeO4的纯度可用滴定法,滴定时有关反应的离子方程式为:a. ![]() +
+ ![]() +2H2O=
+2H2O= ![]() +Fe(OH)3↓+OH;b.2
+Fe(OH)3↓+OH;b.2![]() +2H+=
+2H+= ![]() +H2O;c.
+H2O;c. ![]() +6Fe2++14H+=2Cr3++6Fe3++7H2O。称取2.0g 制备的K2FeO4样品溶于适量KOH 溶液中,加入足量的KCrO2,充分反应后过滤,滤液在250 mL 容量瓶中定容。取25.00 mL 加入稀硫酸酸化,用0.10 mol·L-1的(NH4)2Fe(SO4)2 标准溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液的体积为24.00 mL,则该K2FeO4 样品的纯度为______。
+6Fe2++14H+=2Cr3++6Fe3++7H2O。称取2.0g 制备的K2FeO4样品溶于适量KOH 溶液中,加入足量的KCrO2,充分反应后过滤,滤液在250 mL 容量瓶中定容。取25.00 mL 加入稀硫酸酸化,用0.10 mol·L-1的(NH4)2Fe(SO4)2 标准溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液的体积为24.00 mL,则该K2FeO4 样品的纯度为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com