
100 mL 浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是 ( )
A.加入适量的6 mol·L-1的盐酸 B.加入数滴氯化铜溶液
C.加入适量蒸馏水 D.加入适量的氯化钠溶液
科目:高中化学 来源: 题型:
国家实验室一个研小组发现首例带结晶水的晶体在 5K 下呈现超导性。据报道,该晶体中含有最简式为 CoO2 的层状结构,结构如右图(小球表示Co原子,大球表示O原子)。下列用粗线画出的CoO2层状结构的晶胞(晶胞是在晶体中具有代表性的最小重复单元)示意图不符合化学式的是( )
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
测定1 mol氧气在标准状况下所占体积的实验操作的步骤如下:
①按下图装配实验装置。

②洗净试管然后充分干燥。
③向500 mL烧瓶里装满水,向500 mL烧杯里加入少量水,把连接烧瓶和烧杯的玻璃管A、橡皮管B和玻璃管C中也装满水,在中间不要留下气泡,然后用弹簧夹把橡皮管B夹紧。
④称得试管的质量为14.45 g,往试管里加入KClO3和MnO2的混合物,再称其质量为15.95 g。
⑤打开弹簧夹,把烧杯举起使烧瓶和烧杯中的水面一致,再关闭弹簧夹,然后把烧杯中的水倒掉。
⑥打开弹簧夹,加热试管的混合物到不再产生气体,即水不再流向烧杯时为止。
⑦反应完毕后把装置冷却到室温。
⑧调节烧杯的高度使烧瓶和烧杯中的水面一致,然后再关闭弹簧 夹。
夹。
⑨用500 mL量筒测量烧杯里水的体积为285.0 mL,把它换算为标准状况下氧气的体积为279.7 mL。
⑩再称量冷却后试管的质量为15.55 g。
(1)在操作⑦中,装置冷却时,玻璃管C的出口一直要在烧杯的水中,不能离开水面,其理由是__________________________________________________
_________________________________________________________________。
(2)简述操作⑧的必要性,即为什么要调节烧杯的高度,使烧瓶和烧杯中的水面一致?__________________________________________________________
______________________________________________________________ ___。
___。
(3)标准状况下,1 mol氧气所占的体积(保留小数后两位)为________L;混合物中MnO2的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与人类生活、社会可持续发展密切相关,下列措施有利于节能减排、保护环境的是①加快化石燃料的开采与使用;②研发易降解的生物农药;③应用高效洁净的能源转换技术;④田间焚烧秸秆;⑤推广使用节能环保材料 ⑥废电池进行集中回收处理 ( )
A. ①③⑤⑥ B. ②③⑤⑥ C. ①②④ D. ②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是 ( )
A.含有离子键的化合物一定是离子化合物
B.活泼的金属和活泼的非金属原子之间形成的化学键一定是离子键
C.共价化合物中不可能存在离子键
D.某元素原子最外层只有1个电子,它跟卤素可能形成离子键也可能形成共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
不久前,美国一个海军航空站安装了一 台250 kW的MCFC型燃料电池,该电池可同时供应电和水蒸气,其工作温度为600 ℃~700 ℃,所用燃料为H2,电解质为熔融的K2CO3,已知该电池的总反应为2H2+O2====2H2O, 负极反应为H2+ CO32--2e- ====H2O+CO2,则下列推断正确的是 ( )
A.正极反应为:4OH- ====O2+2H2O+4e- B.放电时CO32- 向负极移动
C.电池供应1 mol水蒸气,转移的电子数为4 mol D.放电时CO32- 向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4 X(g)+5 Y(g)=n Z(g)+6 W(g)。2 min 末测得容器内的压强变为原来压强的1.05倍,且测知前2min内以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1。
求:(1)前2 min内用X的浓度变化表示的平均反应速率?
(2)2min末Y的浓度?
(3)化学反应方程式中n的值?
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知:①Fe(s)+ O2(g)===FeO(s) ΔH1=-272.0 kJ·mol-1;
O2(g)===FeO(s) ΔH1=-272.0 kJ·mol-1;
②2Al(s)+ O2(g)===Al2O3(s) ΔH2=-1 675.7 kJ·mol-1。
O2(g)===Al2O3(s) ΔH2=-1 675.7 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是_____________________________某同学认为,铝热反应可用于工业炼铁,你的判断是______________(填“能”或“不能”),
你的理由是________________________________
(2)发射卫星用N2H4为燃料,NO2为氧化剂,两者反应生成N2和水蒸气, 已知N2(g)+2O2(g)=2NO2(g), 1= +67.7KJ/mol
1= +67.7KJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(l), 2 = —622KJ/mol
2 = —622KJ/mol
H2O(l) = H2O(g) ΔH3 = +44 kJ·mol-1
试写出N2H4与 NO2反应生成N2和水蒸气的热化学方程式__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3、MgO、CaO等,生产工艺流程示意如图下:
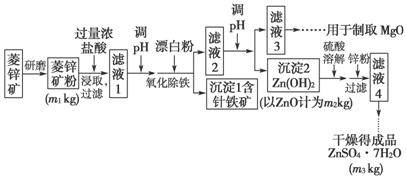
(1)将菱锌矿研磨成粉的目的是____________________________________。
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□______+□______===□Fe(OH)3+□Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是________________。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为___。
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉 淀的pH | 10.4 | 6.4 | ||
| 沉淀完全 的pH | 12.4 | 8.0 | ||
| 开始溶 解的pH | 10.5 | |||
| Ksp | 5.6×10-12 | 6.8×10-6 | 2.8×10-9 |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是________(选填序号)。
a.大理石粉 b.石灰乳
c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为________、________、过滤、洗涤、干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com