
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3、MgO、CaO等,生产工艺流程示意如图下:
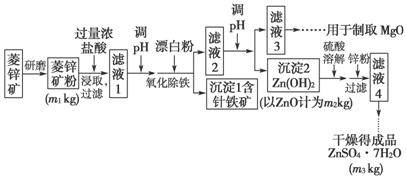
(1)将菱锌矿研磨成粉的目的是____________________________________。
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□______+□______===□Fe(OH)3+□Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是________________。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为___。
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉 淀的pH | 10.4 | 6.4 | ||
| 沉淀完全 的pH | 12.4 | 8.0 | ||
| 开始溶 解的pH | 10.5 | |||
| Ksp | 5.6×10-12 | 6.8×10-6 | 2.8×10-9 |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是________(选填序号)。
a.大理石粉 b.石灰乳
c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为________、________、过滤、洗涤、干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于________。
【解析】 (1) 将菱铁矿研磨成粉可以增加反应时的接触面积,使得反应更加充分。
(2)漂白粉的成分中含有次氯酸根,调节酸碱度后,具有较强的氧化性,能使+2价的亚铁离子氧化成+3价,氢氧化亚铁变成氢氧化铁必须增加氢氧元素的量,可以推测出另一种反应物为水,清楚了反应物,一般可以顺利的配平。
(3) 化学式量为89,组成元素是Fe、O、H,其中铁的相对原子质量为56,扣掉56剩下33,化学式中只能含有2个氧原子和1个氢原子,所以可能的组成为FeO(OH)。
(4)pH=8.0 Zn(OH)2完全沉淀,pH=10.5开始溶解,而Mg(OH)2在pH=10.4的时候开始沉淀,为了使Zn(OH)2能完全析出不影响Mg(OH)2,溶液的酸碱度控制在8.0≤pH≤10.4范围。
(5)a大理石粉难溶于水,选择熟石灰和烧碱溶液可以使溶液的碱性增强,有利于镁离子完全沉淀。
(6)蒸发浓缩、冷却结晶能使晶体尽快的析出。
(7)综合计算(不展开)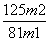
【答案】 (1) 增大反应物接触面积或增加反应时的接触面积,使反应更加充分
(2) 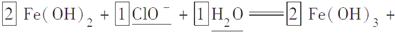

(3)FeO(OH)(或其他合理答案)
(4)8.0≤pH≤10.4(或其他合理答案)
(5)b或(b和d)或d
(6)蒸发浓缩、冷却结晶(或其他合理答案)
(7)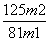 (或其他合理答案)
(或其他合理答案)


科目:高中化学 来源: 题型:
100 mL 浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是 ( )
A.加入适量的6 mol·L-1的盐酸 B.加入数滴氯化铜溶液
C.加入适量蒸馏水 D.加入适量的氯化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是常见四种有机物的比例模型示意图。下列说法正确的是

A.甲能使酸性高锰酸钾溶液褪色
B.乙可与溴水发生取代反应使溴水褪色
C.丙中的碳碳键是介于碳碳单键和碳碳双键之间的独特的键
D.丁在常温下可与乙酸发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
阿伏加德罗常数为NA,下列说法中正确的是( )
A.62 g Na2O溶于水后所得溶液中含有的O2-数为NA
B.在含Al3+总数为NA的AlCl3溶液中,Cl-总数大于3NA
C.常温常压下,16 g甲基(—13CH3)所含的中子数为10NA
D.0.5 mol Cu和足量浓硝酸反应可以生成22.4 L NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
某酸性溶液可能含有Br-、SO 、H2SO3、NH
、H2SO3、NH 等,分别对该溶液进行如下实验:
等,分别对该溶液进行如下实验:
①加热时放出的气体可使品红溶液褪色;
②加入碱溶液使溶液呈碱性,再加热时放出的气体可使湿润的红色石蕊试纸变蓝;
③加入氯水时,溶液略呈橙红色,再加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀。
对于下列物质不能确定其在原溶液中是否存在的是( )
A.Br- B.SO
C.H2SO3 D.NH
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学物质在实际生产生活和科技等方面的应用不正确的是( )
A.测定NaOH熔点时,可以将NaOH放入石英坩埚中高温加热
B.石英砂可以用于制取高纯度的硅,硅是将太阳能转化为电能的常用材料
C.因为氨易液化,液氨在汽化时会吸收大量的热量,所以液氨可作制冷剂
D.硫酸和硝酸都是重要的工业原料,工业上可用于制化肥、农药和炸药
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的量之比为1∶3的锌与稀硝酸混合,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,下列说法正确的是( )
A.在此反应中硝酸体现强氧化性,全部被还原
B.向反应后的溶液中再加入金属铁,不再发生化学反应
C.该反应中被还原的硝酸与未被还原的硝酸之比为1∶4
D.该反应中被还原的硝酸与未被还原的硝酸之比为1∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
臭氧可用于净化空气、饮用水的消毒、处理工业废物和作漂白剂。
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:6Ag(s)+O3(g)===3Ag2O(s) ΔH=-235.8 kJ·mol-1。已知2Ag2O(s)===4Ag(s)+O2(g)
ΔH=+62.2 kJ·mol-1,则常温下反应2O3(g)===3O2(g)的ΔH=________。
(2)配平下面反应的化学方程式(将各物质的化学计量数填在相应的方框内):
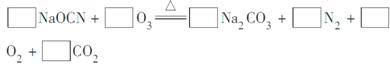
(3)科学家P.Tatapudi等人首先使用在酸性条件下电解水的方法制得臭氧。臭氧在阳极周围的水中产生,电极反应式为3H2O-6e-===O3↑+6H+,阴极附近溶解在水中的氧气生成过氧化氢,其电极反应式为_______________________。
(4)空气中臭氧的检测方法是将空气慢慢通过足量KI淀粉溶液,若溶液变蓝色,则说明空气中含有O3。已知O3与KI溶液反应生成两种单质,则该反应的离子方程式为_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
A.反应AlCl3+4NaOH===NaAlO2+3NaCl+2H2O,可以设计成原电池
B.Zn和稀硫酸反应时,加入少量CuSO4溶液能加快产生H2的速率
C.把Fe片和Cu片放入稀硫酸中,并用导线把二者相连,观察到Cu片上产生大量气泡,说明Cu与H2SO4能发生反应而Fe被钝化
D.金属镀层破损后,镀锌铁比镀锡铁更易被腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com