
物质的量之比为1∶3的锌与稀硝酸混合,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,下列说法正确的是( )
A.在此反应中硝酸体现强氧化性,全部被还原
B.向反应后的溶液中再加入金属铁,不再发生化学反应
C.该反应中被还原的硝酸与未被还原的硝酸之比为1∶4
D.该反应中被还原的硝酸与未被还原的硝酸之比为1∶5
科目:高中化学 来源: 题型:
把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4 X(g)+5 Y(g)=n Z(g)+6 W(g)。2 min 末测得容器内的压强变为原来压强的1.05倍,且测知前2min内以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1。
求:(1)前2 min内用X的浓度变化表示的平均反应速率?
(2)2min末Y的浓度?
(3)化学反应方程式中n的值?
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(如图1),一段时间后换成蒸馏装置(如图2)进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品,请回答下列问题:

(1)在图1烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入________,目的是________。
冷凝管的作用是_____________________。
(2)图2中冷凝水应从________口进。
(3)现设计分离以上粗产品的操作步骤如下图。已知a为饱和碳酸钠溶液,①为分液。请回答:

试剂b是________;分离方法③是________。
(4)某化学课外小组设计了下图所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与图1装置相比,主要优点有(写一点):___________________________
_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3、MgO、CaO等,生产工艺流程示意如图下:
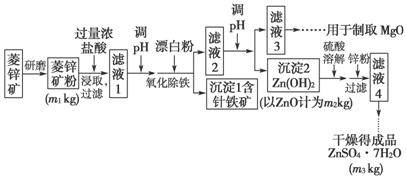
(1)将菱锌矿研磨成粉的目的是____________________________________。
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□______+□______===□Fe(OH)3+□Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是________________。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为___。
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉 淀的pH | 10.4 | 6.4 | ||
| 沉淀完全 的pH | 12.4 | 8.0 | ||
| 开始溶 解的pH | 10.5 | |||
| Ksp | 5.6×10-12 | 6.8×10-6 | 2.8×10-9 |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是________(选填序号)。
a.大理石粉 b.石灰乳
c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为________、________、过滤、洗涤、干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
燃料电池能有效提高能源利用率,具有广泛的应用前景。下列物质均可用作燃料电池的燃料,其中最环保的是( )
A.甲醇 B.天然气
C.液化石油气 D.氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
用 NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.1 mol Na2O2晶体中共含有4NA个离子
B.0.1 mol AlCl3完全水解转化为氢氧化铝胶体,生成0.1 NA个胶粒
C.常温常压下,16 g O2和O3的混合气体中含有NA个氧原子
D.电解精炼铜时每转移NA个电子,阳极溶解32 g铜
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语的使用正确的是( )
A.Cl2通入石灰乳中制漂白粉的离子方程式:
Cl2+2OH-===Cl-+ClO-+H2O
B.利用泡沫灭火器灭火时发生的反应:2Al3++CO +3H2O===2Al(OH)3↓+CO2↑
+3H2O===2Al(OH)3↓+CO2↑
C.已知离子的还原性:Sn2+>Fe2+,则可推测在溶液中能发生如下反应:Sn4++2Fe2+===2Fe3++Sn2+
D.298 K时,已知12 g石墨完全燃烧生成CO2(g)放出393.5 kJ热量,1 mol CO完全燃烧放出283.5 kJ热量,则一定有:C(s,石墨)+ O2(g)===CO(g)
O2(g)===CO(g)
ΔH=-110 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于热化学反应的描述中正确的是 ( )
A.已知中和热为57.3kJ/mol,则HCl + NaOH = NaCl + H2O ΔH=-57.3kJ/mol,
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)ΔH=+2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
为了测定含有H2C2O4·2H2O、KHC2O4和K2SO4的试样中各物质的质量分数,进行如下实验:
①称取6.0 g试样,加水溶解,配成250 mL试样溶液。
②用酸式滴定管量取25.00 mL试样溶液放入锥形瓶中,并加入2~3滴酚酞试液,用0.2500 mol/L NaOH溶液滴定,消耗NaOH溶液20.00 mL。
③再取25.00 mL试样溶液放入另一锥形瓶中,用0.1000 mol/L的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液16.00 mL。
回答下列问题:
(1)已知:0.10 mol/L KHC2O4溶液pH约为3,其中含碳元素的粒子浓度由大到小的顺序为 。
(2)步骤①所需要的玻璃仪器有烧杯、玻璃棒、 、 。
(3) 完成并配平下列离子方程式:
C2O42++ MnO4—+ H+ = CO2+ Mn2++
(4)步骤③中判断滴定终点的方法是 。
(5)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的H2C2O4·2H2O的质量分数 。(填“偏大”、“偏小”或“无影响”)
(6) 试样中H2C2O4·2H2O的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com