
如图是常见四种有机物的比例模型示意图。下列说法正确的是

A.甲能使酸性高锰酸钾溶液褪色
B.乙可与溴水发生取代反应使溴水褪色
C.丙中的碳碳键是介于碳碳单键和碳碳双键之间的独特的键
D.丁在常温下可与乙酸发生取代反应
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
测定1 mol氧气在标准状况下所占体积的实验操作的步骤如下:
①按下图装配实验装置。

②洗净试管然后充分干燥。
③向500 mL烧瓶里装满水,向500 mL烧杯里加入少量水,把连接烧瓶和烧杯的玻璃管A、橡皮管B和玻璃管C中也装满水,在中间不要留下气泡,然后用弹簧夹把橡皮管B夹紧。
④称得试管的质量为14.45 g,往试管里加入KClO3和MnO2的混合物,再称其质量为15.95 g。
⑤打开弹簧夹,把烧杯举起使烧瓶和烧杯中的水面一致,再关闭弹簧夹,然后把烧杯中的水倒掉。
⑥打开弹簧夹,加热试管的混合物到不再产生气体,即水不再流向烧杯时为止。
⑦反应完毕后把装置冷却到室温。
⑧调节烧杯的高度使烧瓶和烧杯中的水面一致,然后再关闭弹簧 夹。
夹。
⑨用500 mL量筒测量烧杯里水的体积为285.0 mL,把它换算为标准状况下氧气的体积为279.7 mL。
⑩再称量冷却后试管的质量为15.55 g。
(1)在操作⑦中,装置冷却时,玻璃管C的出口一直要在烧杯的水中,不能离开水面,其理由是__________________________________________________
_________________________________________________________________。
(2)简述操作⑧的必要性,即为什么要调节烧杯的高度,使烧瓶和烧杯中的水面一致?__________________________________________________________
______________________________________________________________ ___。
___。
(3)标准状况下,1 mol氧气所占的体积(保留小数后两位)为________L;混合物中MnO2的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
把0.4 mol X气体和0.6 mol Y气体混合于2 L密闭容器中,使它们发生如下反应:4 X(g)+5 Y(g)=n Z(g)+6 W(g)。2 min 末测得容器内的压强变为原来压强的1.05倍,且测知前2min内以Z的浓度变化表示的反应速率为0.05 mol·(L·min)-1。
求:(1)前2 min内用X的浓度变化表示的平均反应速率?
(2)2min末Y的浓度?
(3)化学反应方程式中n的值?
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知:①Fe(s)+ O2(g)===FeO(s) ΔH1=-272.0 kJ·mol-1;
O2(g)===FeO(s) ΔH1=-272.0 kJ·mol-1;
②2Al(s)+ O2(g)===Al2O3(s) ΔH2=-1 675.7 kJ·mol-1。
O2(g)===Al2O3(s) ΔH2=-1 675.7 kJ·mol-1。
Al和FeO发生铝热反应的热化学方程式是_____________________________某同学认为,铝热反应可用于工业炼铁,你的判断是______________(填“能”或“不能”),
你的理由是________________________________
(2)发射卫星用N2H4为燃料,NO2为氧化剂,两者反应生成N2和水蒸气, 已知N2(g)+2O2(g)=2NO2(g), 1= +67.7KJ/mol
1= +67.7KJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(l), 2 = —622KJ/mol
2 = —622KJ/mol
H2O(l) = H2O(g) ΔH3 = +44 kJ·mol-1
试写出N2H4与 NO2反应生成N2和水蒸气的热化学方程式__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
下列解释事实的方程式不准确的是
A.用浓盐酸检验氨:NH3+HCl=NH4Cl
B.冷的氢氧化钠溶液吸收氯气: Cl2+2OH-= ClO-+Cl-+H2O
C.钢铁发生吸氧腐蚀时,铁作负极被氧化:Fe-3e-=Fe3+
D.长期盛放石灰水的试剂瓶内壁出现白色固体:Ca(OH)2+CO2=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
 某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叙述正确的是
A.a点是负极,b点是正极
B.铂片一端发生还原反应
C.铅笔端有少量的氯气产生
D.铅笔端作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(如图1),一段时间后换成蒸馏装置(如图2)进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品,请回答下列问题:

(1)在图1烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入________,目的是________。
冷凝管的作用是_____________________。
(2)图2中冷凝水应从________口进。
(3)现设计分离以上粗产品的操作步骤如下图。已知a为饱和碳酸钠溶液,①为分液。请回答:

试剂b是________;分离方法③是________。
(4)某化学课外小组设计了下图所示的制取乙酸乙酯的装置(图中的铁架台、铁夹、加热装置已略去),与图1装置相比,主要优点有(写一点):___________________________
_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3、MgO、CaO等,生产工艺流程示意如图下:
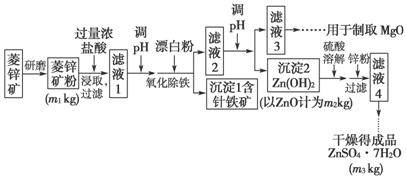
(1)将菱锌矿研磨成粉的目的是____________________________________。
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□______+□______===□Fe(OH)3+□Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是________________。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为___。
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉 淀的pH | 10.4 | 6.4 | ||
| 沉淀完全 的pH | 12.4 | 8.0 | ||
| 开始溶 解的pH | 10.5 | |||
| Ksp | 5.6×10-12 | 6.8×10-6 | 2.8×10-9 |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是________(选填序号)。
a.大理石粉 b.石灰乳
c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为________、________、过滤、洗涤、干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3 的质量分数不低于________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于热化学反应的描述中正确的是 ( )
A.已知中和热为57.3kJ/mol,则HCl + NaOH = NaCl + H2O ΔH=-57.3kJ/mol,
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)ΔH=+2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com