
称取NaOH、Na2CO3的混合物Wg,溶于水中,加入酚酞作指示剂,以Mmol/L的盐酸滴定,耗用V1L时变为粉红色,此时发生的化学反应方程式是_________________________
__________________________________________________________________;若最初以甲基橙作指示剂,当耗用V2L盐酸时变橙色,此时发生的化学反应方程_______________________
______________________________________________由此计算混合物中NaOH和Na2CO3的质量分数分别为多少?
NaOH+HCl=NaCl+H2O、Na2CO3+HCl=NaHCO3+NaCl;
NaOH+HCl=NaCl+H2O、Na2CO3+2HCl=2NaCl+CO2↑+H2O;
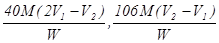
【解析】
试题分析:氢氧化钠是强碱,所以盐酸首先和氢氧化钠反应,方程式是NaOH+HCl=NaCl+H2O;由于碳酸钠和盐酸反应是分步进行的,因此当溶液变为粉红色时,碳酸钠变成了碳酸氢钠,即反应的化学方程式是Na2CO3+HCl=NaHCO3+NaCl;由于甲基橙的变色范围是3.1~4.4,因此如果当溶液变为橙色时,上面碳酸钠和盐酸反应生成了CO2,所以此时的反应的化学方程式分别是NaOH+HCl=NaCl+H2O、Na2CO3+2HCl=2NaCl+CO2↑+H2O;如果把碳酸钠和盐酸的反应酚两步完成,则依据题意可知,和碳酸氢钠反应的盐酸的体积应该是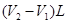 ,所以根据碳原子守恒可知,碳酸钠的物质的量是
,所以根据碳原子守恒可知,碳酸钠的物质的量是 ,因此碳酸钠的质量分数是
,因此碳酸钠的质量分数是 。根据以上分析可知,和氢氧化钠反应的盐酸的体积是
。根据以上分析可知,和氢氧化钠反应的盐酸的体积是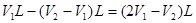 ,所以氢氧化钠的质量分数是
,所以氢氧化钠的质量分数是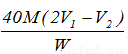 。
。
考点:考查酸碱中和的有关计算、碳酸钠和盐酸反应的有关判断
点评:本题是中等难度的试题,试题侧重能力的考查,主要是考查学生的逻辑思维能力。该题的关键是掌握指示剂的变色范围,特别是碳酸钠和盐酸的反应原理。该题只要能够理解碳酸钠和盐酸的反应原理,就不难得出正确的答案。


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源:2012年苏教版高中化学选修6 6.2镀锌铁皮锌镀层厚度的测定练习卷(解析版) 题型:填空题
已知Zn(OH)2能溶于NaOH溶液转变成Na2[Zn(OH)4]。为了测定某白铁皮中锌的质量分数,进行如下实验:取a g白铁皮样品于烧杯中,加入过量稀盐酸,用表面皿盖好,开始时产生气泡的速度很快,以后逐渐变慢。待试样全部溶解后,向烧杯中加入过量NaOH溶液,充分搅拌后过滤,将所得沉淀在空气中加强热至质量不变,称得残留固体质量为b g。
(1)白铁皮镀锌的目的是
________________________________________________________________________。
(2)气泡产生速度先快后慢的原因是
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(3)溶液中加入过量NaOH溶液,发生反应的离子方程式是(不是离子反应的写化学方程式):
________________________________________________________________________;
________________________________________________________________________;
________________________________________________________________________;
________________________________________________________________________。
(4)最后残留的固体是__________,得到该固体的化学反应方程式是
________________________________________________________________________。
(5)白铁皮含锌的质量分数是______________(用含a、b的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com