
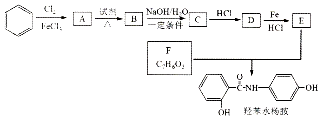
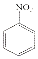
 $→_{HCl}^{Fe}$
$→_{HCl}^{Fe}$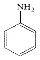
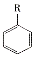 (R-烷基)$\stackrel{KMnO_{4}/H+}{→}$
(R-烷基)$\stackrel{KMnO_{4}/H+}{→}$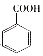
 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +NaCl+H2O.
+NaCl+H2O. .
. 的合成路线
的合成路线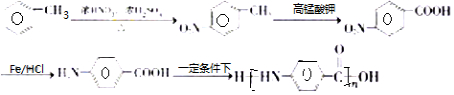 .
. 分析 由羟苯水杨胺结构简式、F的分子式可知,F为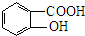 ,E为
,E为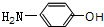 ,由反应信息逆推可知D为
,由反应信息逆推可知D为 ,由转化关系可知,苯与氯气发生取代反应生成A为
,由转化关系可知,苯与氯气发生取代反应生成A为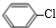 ,A与浓硝酸、浓硫酸在加热条件下发生取代反应生成B为
,A与浓硝酸、浓硫酸在加热条件下发生取代反应生成B为 ,B发生水解反应生成C为
,B发生水解反应生成C为 ,C酸化得到D,以此解答(1)~(5);
,C酸化得到D,以此解答(1)~(5);
(6)制备高聚物  ,由逆合成法可知,对氨基苯甲酸←对硝基苯甲酸←对硝基苯甲苯←甲苯,以此来解答.
,由逆合成法可知,对氨基苯甲酸←对硝基苯甲酸←对硝基苯甲苯←甲苯,以此来解答.
解答 解:(1)由羟苯水杨胺的结构简式,可知其化学式为C13H11NO3,F为 ,含羟基、羧基,
,含羟基、羧基,
故答案为:C13H11NO3;羟基、羧基;
(2)A为 ,名称为氯苯,故答案为:氯苯;
,名称为氯苯,故答案为:氯苯;
(3)A→B所需试剂为:浓硝酸和浓硫酸,D→E中硝基转化为氨基,反应类型属于为还原反应,
故答案为:浓硝酸和浓硫酸;还原反应;
(4)B→C反应的化学方程式为 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +NaCl+H2O,
+NaCl+H2O,
故答案为: +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +NaCl+H2O;
+NaCl+H2O;
(5)F( )的同分异构体中既能与FeCl3发生显色反应,又能发生银镜反应,说明含有酚羟基、醛基,侧链为-OH、-OOCH时,有邻、间、对3种,侧链可为-CHO、2个-OH,2个-OH处于邻位,-CHO有2种位置,2个-OH处于间位,-CHO有3种位置,2个-OH处于对位,-CHO有1种位置,共9种;其中核磁共振氢谱显示4组峰,发生水解反应含HCOOC-,且峰面积之比为1:2:2:1的同分异构体的结构简式为
)的同分异构体中既能与FeCl3发生显色反应,又能发生银镜反应,说明含有酚羟基、醛基,侧链为-OH、-OOCH时,有邻、间、对3种,侧链可为-CHO、2个-OH,2个-OH处于邻位,-CHO有2种位置,2个-OH处于间位,-CHO有3种位置,2个-OH处于对位,-CHO有1种位置,共9种;其中核磁共振氢谱显示4组峰,发生水解反应含HCOOC-,且峰面积之比为1:2:2:1的同分异构体的结构简式为 ,
,
故答案为:9; ;
;
(5)制备高聚物  ,由逆合成法可知,对氨基苯甲酸←对硝基苯甲酸←对硝基苯甲苯←甲苯,合成流程为
,由逆合成法可知,对氨基苯甲酸←对硝基苯甲酸←对硝基苯甲苯←甲苯,合成流程为 ,
,
故答案为: .
.
点评 本题考查有机物的合成,为高频考点,把握合成流程中官能团的变化、碳链骨架、有机反应为解答的关键,侧重分析与推断能力的考查,注意有机物性质的应用,题目难度不大.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 将1 mol PbS冶炼成Pb理论上至少需要6 g碳 | |
| B. | 浮选法富集方铅矿的过程属于化学变化 | |
| C. | 方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO | |
| D. | 整个冶炼过程中,制取1 mol Pb共转移2 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
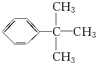 ;乙能被高锰酸钾酸性溶液氧化为分子式C8H6O4的羧酸,则乙可能的结构有9种.
;乙能被高锰酸钾酸性溶液氧化为分子式C8H6O4的羧酸,则乙可能的结构有9种. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热前称量时坩埚未完全干燥 | B. | 加热时间过长,晶体部分变黑 | ||
| C. | 加热过程中有少量晶体溅出 | D. | 在空气中冷却 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示.试回答:
取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶、10mL量筒 | B. | 容量瓶、100mL量筒 | ||
| C. | 100mL容量瓶、50mL量筒 | D. | 100mL容量瓶、10mL量筒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁胶体带正电 | |
| B. | 胶体加入电解质可产生沉淀,而溶液不能 | |
| C. | 由于胶体是一种介稳性的分散系,因此不易聚沉 | |
| D. | 胶体能够发生丁达尔现象,而溶液则不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝溶于氢氧化钠溶液:Al+2OH-+H2O═A1O2-+2H2↑ | |
| B. | 用H2O2从酸化的海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- | |
| C. | 将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| D. | 向苯酚钠溶液中通入少量的CO2:2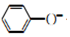 +CO2+H2O→2 +CO2+H2O→2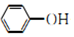 +CO${\;}_{3}^{2-}$ +CO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,等质量的N2和CO气休的原子数均为2NA | |
| B. | 在反应KC1O4+8HCI=KCl+4Cl2↑+4H2O中,每生成4molCl2转移的电子数为8NA | |
| C. | 含有3mol离子的过氧化钠固体和足量的水反应,电子转移数为NA | |
| D. | 标准状况下,80gSO3中含3NA个氧原子,体积约为22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com