
| A. | 加热前称量时坩埚未完全干燥 | B. | 加热时间过长,晶体部分变黑 | ||
| C. | 加热过程中有少量晶体溅出 | D. | 在空气中冷却 |
分析 在测定硫酸铜晶体结晶水含量的实验中,加热前后的质量差为失去结晶水的质量,质量差偏大,n值就偏大,若质量差,则测定的n值偏小,据此进行解答.
解答 解:A.加热前称量时坩埚未完全干燥,加热后水分蒸发,导致测定的结晶水的质量差偏大,测定结果偏大,故A错误;
B.加热时间过长,晶体部分变黑是硫酸铜加热分解产生氧化铜和三氧化硫等,导致测定的结晶水的质量差偏大,测定结果偏大,故B错误;
C.加热过程中有少量晶体溅出,导致测定的结晶水的质量差偏大,测定结果偏大,故C错误;
D.在空气中冷却,导致测定的结晶水质量偏小,测定结果偏小,故D正确;
故选D.
点评 本题考查了硫酸铜晶体中结晶水的测定,题目难度不大,把握实验操作原理及实验注意事项分析质量差是解题的关键,试题培养了学生的化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 使酚酞溶液变红的溶液:H+、C1-、NO3-、Ba2+ | |
| B. | 澄清透明的溶液:MnO4-、Al3+、SO42-、K+ | |
| C. | 强碱性溶液:K+、Mg2+、HCO3-、NO3- | |
| D. | 无色的溶液:CO32-、SO42-、Cu2+、NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 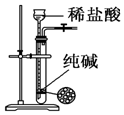 用图装置制取少量CO2气体 | |
| B. | 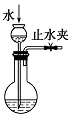 图可检查该装置的气密性 | |
| C. | 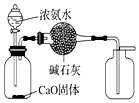 用图装置制取并收集干燥的NH3 | |
| D. | 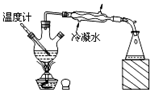 装置可分离沸点不同且互溶的液体混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三处 | B. | 四处 | C. | 五处 | D. | 六处 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | Mg(OH)2与H2SO4反应:Mg2++2OH-+2H++SO42-═MgSO4↓+2H2O | |
| C. | 镁与醋酸反应 Mg+2H+═Mg2++H2↑ | |
| D. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
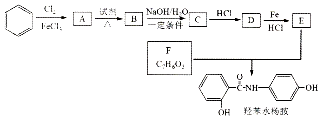
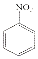 $→_{HCl}^{Fe}$
$→_{HCl}^{Fe}$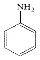
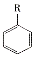 (R-烷基)$\stackrel{KMnO_{4}/H+}{→}$
(R-烷基)$\stackrel{KMnO_{4}/H+}{→}$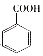
 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$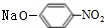 +NaCl+H2O.
+NaCl+H2O. .
.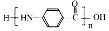 的合成路线
的合成路线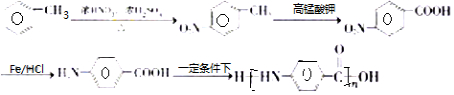 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:下列有关说法不正确的是( )
生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:下列有关说法不正确的是( )| A. | NaHCO3溶液的物质的量浓度为0.8 mol/L | |
| B. | b点与c点溶液所含微粒种类相同 | |
| C. | a点溶液中存在的离子是Na+、AlO2-、OH-、H+ | |
| D. | 生成沉淀的离子方程式为:HCO3-+AlO2-+H2O═Al(OH)3↓+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| HClO | HSCN | H2CO3 |
| K=3.2×10-8 | K=0.13 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com