有浓度均为0.1mol?L-1的盐酸、硫酸和醋酸三种溶液,试分析:
(1)若溶液的c(H+)分别为a、b、c,则它们的大小关系是______(用“>”“<”“=”表示).
(2)分别用三种酸中和等物质的量的氢氧化钠溶液,所需溶液的体积分别是a、b、c,则它们的大小关系是______(用“>”“<”“=”表示).
(3)等体积的三种酸分别与足量的锌粒反应,在相同条件下若产生气体的体积分别为a、b、c,则它们的关系是______.
(4)室温下,pH=5的盐酸,若将其加水稀释至原体积的500倍,则C(H+):C(Cl-)约为______.
解:(1)硫酸和盐酸是强酸,醋酸是弱酸,则c(H
+)=c(HCl)=0.1mol/L,c(H
+)=2c(H
2SO
4)=0.2mol/L,c(H
+)<c(CH
3COOH)=0.1mol/L,所以它们的大小关系是b>a>c,故答案为:b>a>c;
(2)三种酸的浓度相等,盐酸和醋酸都是一元酸,硫酸是二元酸,硫酸溶液中氢离子浓度是盐酸溶液中的2倍,则完全中和物质的量均相同的三份NaOH溶液时,盐酸和醋酸需要的体积相等,需要硫酸的体积是盐酸的一半,所以需三种酸的体积大小关系是a=c=2b,故答案为:a=c=2b;
(3)等体积等浓度的三种酸中,氢元素的物质的量2n(HCl)=2n(CH
3COOH)=n((H
2SO
4),根据氢原子守恒知,生成氢气的体积大小顺序是a=c=
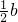
,故答案为:a=c=
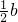
;
(4)室温下,pH=5的盐酸,若将其加水稀释至原体积的500倍,C(Cl
-)是原来的
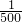
为2×10
-8mol/L,则氢离子浓度=(10
-7+
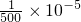
)mol/L=12×10
-8mol/L,所以C(H
+):C(Cl
-)约为6:1,故答案为:6:1.
分析:(1)硫酸和盐酸是强酸,醋酸是弱酸,则c(H
+)=c(HCl),c(H
+)=2c(H
2SO
4),c(H
+)<c(CH
3COOH);
(2)酸碱中和时,氢元素的物质的量和氢氧根离子的物质的量相等;
(3)根据氢原子守恒计算生成氢气体积的大小关系;
(4)根据稀释时氯离子的物质的量不变计算氯离子的物质的量浓度,注意溶液的pH接近中性时要考虑水的电离.
点评:本题考查电解质的电离,注意无论如何稀释酸或碱,酸不能变为碱,碱不能变为酸,稀释过程中,当溶液接近中性时,要考虑水的电离,为易错点.

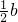 ,故答案为:a=c=
,故答案为:a=c=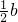 ;
;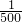 为2×10-8mol/L,则氢离子浓度=(10-7+
为2×10-8mol/L,则氢离子浓度=(10-7+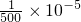 )mol/L=12×10-8mol/L,所以C(H+):C(Cl-)约为6:1,故答案为:6:1.
)mol/L=12×10-8mol/L,所以C(H+):C(Cl-)约为6:1,故答案为:6:1.

 阅读快车系列答案
阅读快车系列答案