
【题目】下图是组成细胞的主要元素及其比例。根据图中所示信息回答下列问题:

(1)组成生物体的最基本元素占细胞鲜重的__________________。
(2)O、H、N三种化学元素在细胞鲜重中共占比例为________,而这三种元素在组成岩石圈的化学成分中,质量分数还不到1%,这个事实说明了____________________________________。
(3)____________元素在生物体内含量虽然很少,却是维持正常生命活动不可缺少的。比如_______________(至少写两种)
【答案】 18% 78% 生物界与非生物界具有差异性 微量 Cu、Mn、B、Zn、Mo、Fe
【解析】试题分析:组成生物体的化学元素根据其含量不同分为大量元素和微量元素两大类。大量元素是指含量占生物总重量万分之一以上的元素,包括C、H、O、N、P、S、K、Ca、Mg,其中C、H、O、N为基本元素,C为最基本元素,O是含量最多的元素;微量元素是指含量占生物总重量万分之一以下的元素,包括Fe、Mn、Zn、Cu、B、Mo等。
(1)组成生物体的最基本元素是C,据图分析可知,其占细胞鲜重的18%。
(2)C、H、N三种化学元素在细胞中所占比例是65%+10%+3%=78%,而这三种元素在组成岩石圈的化学成分中,质量分数还不到1%,说明了生物界和非生物界之间存在差异性。
(3)微量元素在生物体内含量很少,但是作用是不可替代的,常见的微量元素有Cu、Mn、B、Zn、Mo、Fe等。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】根据反应:S2O32-+2H+==SO2+S↓+H2O,下表各组实验最快出现浑浊的是
Na2S2O3溶液 | 稀H2SO4 | H2O | 温度/℃ | |||
c(mol·L-1) | V(mL) | c(mol·L-1) | V(mL) | V(mL) | ||
A | 0.1 | 5 | 0.1 | 5 | 5 | 10 |
B | 0.2 | 5 | 0.1 | 5 | 10 | 10 |
C | 0.1 | 5 | 0.1 | 5 | 10 | 30 |
D | 0.2 | 5 | 0.1 | 5 | 10 | 30 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向胶体中加入电解质,能使胶体凝聚。使一定量的胶体在一定时间内开始凝聚所需电解质的浓度(mol·L1)称作“聚沉值”。电解质的聚沉值越小,则表示其凝聚能力越大,实验证明,凝聚能力主要取决于与胶粒带相反电荷的离子所带的电荷数,电荷数越多,凝聚力越大。已知Fe(OH)3胶粒带正电,则向Fe(OH)3胶体中加入下列电解质时,其“聚沉值”最小的为
A.NaCl B.FeCl3
C.K2SO4 D.Na3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物体内的各种化学反应,几乎都是由酶催化的,请回答有关问题:

(1)甲、乙两种酶用同一种RNA酶处理,酶活性与处理时间的关系如图所示,则初步推测乙酶的化学本质为RNA,甲酶的化学本质为________。要鉴定甲酶的化学本质,可将该酶液与________试剂混合。该图可以体现酶的哪一种特性?________
(2)若要提高衣物上油渍的去除效果,洗衣粉中可添加________酶;使用加酶洗衣粉时,水温过低或过高时洗涤效果不好的原因分别是 ; 。
(3)若测定某种酶在不同温度下的活性(无关变量均适宜且相同),反应液中应加入________以维持其酸碱度稳定,酶促反应的速率可用 来表示。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示. 
(1)反应物是 , 生成物是
(2)X的转化率是
(3)由图中所给数据进行分析,该反应的化学方程为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)CO2(g)+H2(g)△H<0,下列对图象的分析中不正确的是( ) 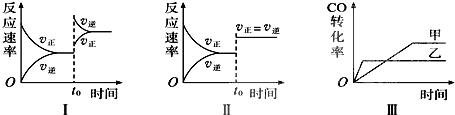
A.图Ⅰ研究的是t0时升高温度对反应速率的影响
B.图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响
C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率分别为:
①v(A)=0.45 molL-1min-1 ②v(B)=0.6 molL-1s-1
③v(C)=0.4 molL-1s-1 ④v(D)=0.45 molL-1s-1
下列有关反应速率的比较中正确的是
A. ④>③=②>①B. ③=②<④<①
C. ①>②>③>④D. ④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu及其化合物在科学研究和工业生产中具有许多用途.请回答以下问题:
(1)向CuSO4溶液中滴加氨水至深蓝色透明溶液时,发生的离子反应方程式 .
(2)硫酸铜溶液中滴入氨基乙酸钠(H2N﹣CH2﹣COONa)即可得到配合物A.其结构如图: 
①SO42﹣中S原子的轨道杂化类型是;
②A中碳原子的轨道杂化类型为 .
③1mol氨基乙酸钠含有σ键的数目为 .
(3)元素金(Au)处于周期表中的第六周期,与Cu同族.一种铜合金晶体具有面心立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,该合金中每一层均为(填“密置层”、“非密置层”);该晶体中,原子之间的作用力是;
(4)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的晶胞结构相似,该晶体储氢后的化学式应为 . 若Cu原子与Au原子的距离为a cm,则该晶体储氢后的密度为 . (含a的表达式)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com