
温度相同,浓度均为0.2 mol·L-1的①(NH4)2SO4,②NaNO3,③NH4HSO4,④NH4NO3,⑤CH3COONa溶液,它们的pH由小到大的排列顺序是 ( )
A.③①④②⑤ B.①③⑤④②
C.③②①⑤④ D.⑤②④①③
 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构。下列说法正确的是
A.原子最外层电子数:X>Y>Z B.单质沸点:X>Z>Y
C.离子半径:X2->Y+>Z- D.原子序数:X>Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:(1)2Fe3++2I-=2Fe2++I2 (2)Br2+2Fe2+=2Br-+2Fe3+,由此可判断有关离子的还原性从强到弱的顺序是( )
A.Br->Fe2+>I- B.I->Fe2+>Br- C.Br->I->Fe2+ D.Fe2+>I->Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
在HNO3、Al(NO3)3和Mg(NO3)2的混合溶液中逐滴加入NaOH溶液,则消耗NaOH溶液的体积(x轴)与生成沉淀(y轴)之间的关系表示正确的是 ( )
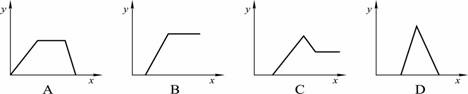
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(NH4+)>c(OH-)>c(Cl-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解一种溶质,则该溶质是 ,上述四种离子浓度的大小顺序为(填序号)________________。
(2)若四种离子的关系符合③,则溶质为 ;
若四种离子的关系符合④,则溶质为 。
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图象正确的是(填图象符号)________。
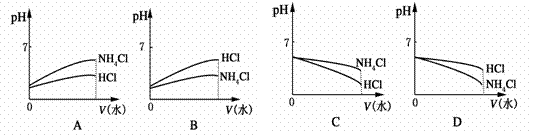
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3 2HNO3+4N2↑+9H2O,在反应中被还原与被氧化的氮原子数之比为
2HNO3+4N2↑+9H2O,在反应中被还原与被氧化的氮原子数之比为
A.5∶4 B.5∶3 C.1∶1 D.3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
榴石矿石可以看作CaO、FeO、Fe2O3、A12O3、SiO2组成。工业上对其进行综合利用的流程如下:
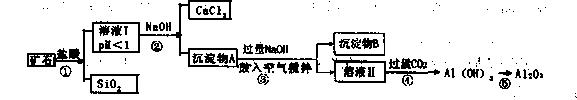
(1)SiO2的用途广泛,试写出其中的一种重要用途 ;
(2)溶液Ⅰ中除了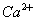 外,还含有的金属阳离子有 ;
外,还含有的金属阳离子有 ;
(3)步骤③中NaOH参加反应的离子方程式是 ,鼓入空气并充分搅拌的目的是 。
(4)在工业生产中,步骤④通入过量CO2而不加入盐酸的原因是
(5)试设计实验证明榴石矿中含有FeO(试 剂任选,说明实验操作与现象)
剂任选,说明实验操作与现象)
查看答案和解析>>
科目:高中化学 来源: 题型:
锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如下:
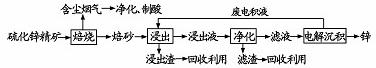
请回答下列问题。
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,主要成分发生反应的化学方程式为 。
(2) 焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的 操作。工业上制备该酸的三个主要阶段分别为 、 、 。
(3)浸出液“净化”过程中加入的主要物质为 ,其作用是 。
(4)电解沉淀过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,锌在 极沉积,阳极的电极反应方程式为 。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种工业价值的非金属单质。“氧压酸浸”发生主要反应的离子方程式为 。
(6)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于“升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”该炼锌工艺过程主要反应的化学方程式为 。(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com