
锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如下:
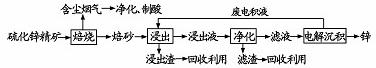
请回答下列问题。
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,主要成分发生反应的化学方程式为 。
(2) 焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的 操作。工业上制备该酸的三个主要阶段分别为 、 、 。
(3)浸出液“净化”过程中加入的主要物质为 ,其作用是 。
(4)电解沉淀过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,锌在 极沉积,阳极的电极反应方程式为 。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种工业价值的非金属单质。“氧压酸浸”发生主要反应的离子方程式为 。
(6)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于“升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”该炼锌工艺过程主要反应的化学方程式为 。(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)
【知识点】金属冶炼的一般原理、物质分离和提纯的方法和基本操作综合应用C5G2
【答案解析】
(15分)(1) ZnS+O3 ZnO+SO2 (2分)
ZnO+SO2 (2分)
(2)浸出 催化 氧化 吸收 (各1分.共4分)
(3)锌粉 置换出Fe等 (各1分,共2分)
(4)阴(1分) 4OH--4e-=2H2O+O2↑ (2分)
(5)2ZnS+4H++O2=2Zn2++2S↓+2H2O (2分)
(6)ZnCO3+2C Zn+3CO↑ (2分)
Zn+3CO↑ (2分)
解析:(1)含锌矿的主要成分是ZnS,与空气中氧气发生氧化还原反应,焙砂的主要成分为ZnO,反应方程式为:ZnS+O3 ZnO+SO2;
ZnO+SO2;
(2)焙烧生成的含硫氧化物可转换为硫酸,用于后续的浸出操作;
工业上制备硫酸的三个主要阶段分别为催化 、氧化、吸收;
(3)该含锌矿中还含有FeS等杂质,浸出操作后转化为亚铁离子,可加入锌粉出去亚铁离子,从而出去Fe等;
(4)电解沉积过程中,是电解ZnSO4,阴极锌离子放电生成锌,故锌在阴极沉积;阳极发生氧化反应,产物为O2,电极反应式为:4OH--4e-=2H2O+O2↑;
(5)“氧压酸浸”法顾名思义,可知反应物中含有H+和O2,可以获得非金属单质S,写出化学方程式为:2ZnS+4H++O2=2Zn2++2S↓+2H2O
(6)根据题目描述可知反应物为ZnCO3和C,产物含有Zn,则化学方程式为:ZnCO3+2C Zn+3CO↑
Zn+3CO↑
【思路点拨】本题难度不大,掌握氧化物的特征、利用化合价的原则计算指定元素的化合价的方法、化学方程式的书写方法、含杂质物质的化学方程式的计算等是正确解答本题的关键。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
温度相同,浓度均为0.2 mol·L-1的①(NH4)2SO4,②NaNO3,③NH4HSO4,④NH4NO3,⑤CH3COONa溶液,它们的pH由小到大的排列顺序是 ( )
A.③①④②⑤ B.①③⑤④②
C.③②①⑤④ D.⑤②④①③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中错误的是 ( )
A.从1 L 1 mol/L的NaCl溶液中取出10 mL,其浓度仍是1 mol/L
B.制成0.5 L 10 mol/L的盐酸,需要氯化氢气体112 L(标准状况)
C.0.5 L 2 mol/L BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D.10 g 98%的硫酸(密度为1.84 g/cm3)与10 mL 18.4 mol/L硫酸的浓度是不同的
查看答案和解析>>
科目:高中化学 来源: 题型:
对溴甲苯是合成农药溴螨酯的重要原料。工业用液溴、甲苯与1-丙醇共热合成对溴甲苯和1-溴丙烷,其原子利用率很高。实验室模拟的合成流程和相关数据如下:已知:甲苯与溴在有水存在时能反应。
| 物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 |
| 沸点℃ | 110.8 | 97.2 | 71 |
| 物质 | 对溴甲苯 | 邻溴甲苯 | |
| 沸点℃ | 184.3 | 181.7 |
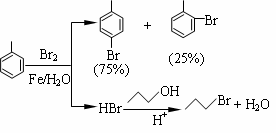
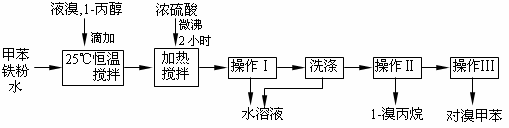
(1)液溴的颜色是__ __ __,实验室存放液溴时应密闭保存,同时需要在试剂瓶中加__ ___,以减少挥发。
(2)25℃恒温搅拌至溴的颜色完全褪去时完成甲苯的溴代反应。搅拌的目的是__________。加入水的作用是:易于控制温度;____________________。
(3)加热搅拌操作中加入浓硫酸,搅拌,完成1-丙醇的取代反应,加入浓硫酸的作用是___ ___,加热微沸2小时的目的是_______ _____。
(4)操作Ⅰ的名称是___________,洗涤操作应在_________(填写仪器名称)中进行。
(5)经以上分离操作后,粗对溴甲苯中还含有的最主要杂质为________(填写名称),使用操作Ⅱ分离出1-溴丙烷的原理是______________________________________。
(6)分离出的水溶液中含HBr、H2SO4和Fe3+离子,将水溶液稀释定容至1000mL,取20.00mL,加入几滴甲基橙作指示剂,用一定浓度的NaOH溶液滴定,测定出HBr的物质的量明显低于理论值,原因是_____________________;有同学认为无需加入指示剂,也能完成滴定,提出这一观点的理由是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子方程式的是
A.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
B.将过量的SO2通入Ca(ClO)2溶液中:SO2 +ClO-+H2O =HClO+HSO3-
C.硫酸亚铁溶液中加入酸化的双氧水:2Fe2+ +2H++H2O2=2Fe3++2H2O
D.等物质的量的MgC12 、Ba(OH)2和HCl溶液混合:Mg2+ +2OH- =Mg( OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作或原理不正确的是( )
|
| A. | 纸层析法中的展开剂之所以能够展开的主要原理是毛细现象 |
|
| B. | 分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒 |
|
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
|
| D. | 测定溶液pH的操作:将pH试纸置于表面皿上,用玻璃棒蘸取溶液,点在pH试纸的中部,与对应的标准比色卡比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:
欲配制100mL 1.0mol•L﹣1Na2SO4溶液,正确的方法是( )
①将14.2g Na2SO4溶于100mL水中
②将32.2gNa2SO4•10H2O溶于少量水 中,再用水稀释至100mL
③将20mL 5.0mol•L﹣1Na2SO4溶液用水稀释至100mL.
|
| A. | ①② | B. | ②③ | C. | ①③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,正确的是
A.太阳能、核能和天然气都属于新型能源
B.哥本哈根气候大会讨论的减排目标主要是控制二氧化硫排放
C.84消毒液具有强氧化性,可杀死流感病毒
D.比黄金还贵的18O2和普通的16O2是两种不同的核素
查看答案和解析>>
科目:高中化学 来源: 题型:
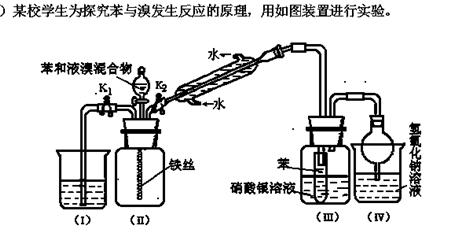
根据相关知识回答下列问题:
(1)实验开始时,关闭K1,开启K2和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。过一会儿,在(III)中可能观察到的现象是 ▲ 。
(2)整套实验装置中能防止倒吸的装置有 ▲ (填装置序号)。
(3)反应结束后要使装置(I)中的水倒吸入装置(II)中。这样操作的目的是 ▲ 。简述这一操作方法 ▲ 。
(4)你认为通过该实验后,有关苯跟溴反应的原理方面能得出的结论是 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com