
下列说法中错误的是 ( )
A.从1 L 1 mol/L的NaCl溶液中取出10 mL,其浓度仍是1 mol/L
B.制成0.5 L 10 mol/L的盐酸,需要氯化氢气体112 L(标准状况)
C.0.5 L 2 mol/L BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D.10 g 98%的硫酸(密度为1.84 g/cm3)与10 mL 18.4 mol/L硫酸的浓度是不同的
科目:高中化学 来源: 题型:
已知:(1)2Fe3++2I-=2Fe2++I2 (2)Br2+2Fe2+=2Br-+2Fe3+,由此可判断有关离子的还原性从强到弱的顺序是( )
A.Br->Fe2+>I- B.I->Fe2+>Br- C.Br->I->Fe2+ D.Fe2+>I->Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3 2HNO3+4N2↑+9H2O,在反应中被还原与被氧化的氮原子数之比为
2HNO3+4N2↑+9H2O,在反应中被还原与被氧化的氮原子数之比为
A.5∶4 B.5∶3 C.1∶1 D.3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
榴石矿石可以看作CaO、FeO、Fe2O3、A12O3、SiO2组成。工业上对其进行综合利用的流程如下:
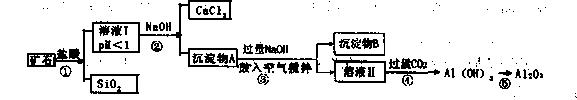
(1)SiO2的用途广泛,试写出其中的一种重要用途 ;
(2)溶液Ⅰ中除了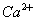 外,还含有的金属阳离子有 ;
外,还含有的金属阳离子有 ;
(3)步骤③中NaOH参加反应的离子方程式是 ,鼓入空气并充分搅拌的目的是 。
(4)在工业生产中,步骤④通入过量CO2而不加入盐酸的原因是
(5)试设计实验证明榴石矿中含有FeO(试 剂任选,说明实验操作与现象)
剂任选,说明实验操作与现象)
查看答案和解析>>
科目:高中化学 来源: 题型:
对于实验I〜IV的描述正确的是 ( )
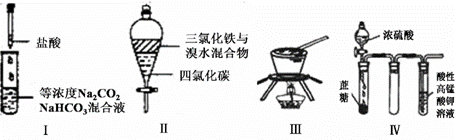
A.实验I :逐滴滴加稀盐酸时,试管中立即产生大量气泡
B.实验II:充分振荡后静置,下层溶液为橙红色,上层无色
C.实验III:从饱和食盐水中提取NaCl晶体
D.装置IV:酸性KMnO4溶液中有气泡出现,且溶液颜色逐渐变浅乃至褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越越成为人们研制绿色原电池的关注焦点。其中一种镁原电池的反应为:
x Mg+Mo3S4 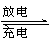
 Mgx Mo3S4 。下列说法错误的是( )
Mgx Mo3S4 。下列说法错误的是( )
A.放电时Mg2+向正极迁移
B.充电时阳极反应为:Mo3S42x-—2xe =Mo3S4
C.充电时Mo3S4发生氧化反应
D.放电时负极反应为:xMg 2xe = xMg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
①pH=2的CH3COOH溶液;②pH=2的HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液。相同条件下,有关上述溶液的比较中,不正确的是( )
A.水电离的c(H+):①=②=③=④
B.若将②、③溶液混合后,pH=7,则消耗溶液的体积:②>③
C.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
D.向溶液中加入100mL水后,溶液的pH:③>④>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如下:
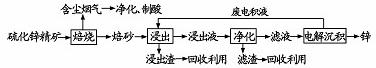
请回答下列问题。
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,主要成分发生反应的化学方程式为 。
(2) 焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的 操作。工业上制备该酸的三个主要阶段分别为 、 、 。
(3)浸出液“净化”过程中加入的主要物质为 ,其作用是 。
(4)电解沉淀过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,锌在 极沉积,阳极的电极反应方程式为 。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种工业价值的非金属单质。“氧压酸浸”发生主要反应的离子方程式为 。
(6)我国古代曾采用“火法”工艺冶炼锌。明代宋应星著的《天工开物》中有关于“升炼倭铅”的记载:“炉甘石十斤,装载入一泥罐内,……,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”该炼锌工艺过程主要反应的化学方程式为 。(注:炉甘石的主要成分为碳酸锌,倭铅是指金属锌)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com