
镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越越成为人们研制绿色原电池的关注焦点。其中一种镁原电池的反应为:
x Mg+Mo3S4 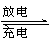
 Mgx Mo3S4 。下列说法错误的是( )
Mgx Mo3S4 。下列说法错误的是( )
A.放电时Mg2+向正极迁移
B.充电时阳极反应为:Mo3S42x-—2xe =Mo3S4
C.充电时Mo3S4发生氧化反应
D.放电时负极反应为:xMg 2xe = xMg2+
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤
②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液其中正确的是( )
A.①④②⑤③ B.④①②⑤③ C.②⑤④①③ D.⑤②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列溶液中,各组离子一定能够大量共存的是
A.常温下水电离出的c(OH-)=10-13的溶液中:Na+、ClO-、F-、K+
B.能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br-
C.含有大量Al3+的溶液:Na+、Cl-、S2-、OH-
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO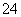 、S2-、SO
、S2-、SO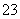
查看答案和解析>>
科目:高中化学 来源: 题型:
元素及其化合物丰富了物质世界,下列说法正确的是( )
A.铜在冷的浓硫酸中会钝化,所以把铜放入冷的浓硫酸中无明显现象
B.NaOH溶液和AlCl3溶液相互滴加的现象不同
C.金属比非金属易失电子,所以金属可以置换非金属,而非金属不能置换金属
D.Al与热水反应困难,故活泼性不及Al的金属在任何条件下均不能与H2O发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中错误的是 ( )
A.从1 L 1 mol/L的NaCl溶液中取出10 mL,其浓度仍是1 mol/L
B.制成0.5 L 10 mol/L的盐酸,需要氯化氢气体112 L(标准状况)
C.0.5 L 2 mol/L BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D.10 g 98%的硫酸(密度为1.84 g/cm3)与10 mL 18.4 mol/L硫酸的浓度是不同的
查看答案和解析>>
科目:高中化学 来源: 题型:
某pH=1的X溶液中可能含有Fe2+、A13+、NH4+、CO32―、SO32―、SO42―、C1―中的若干种,现取X溶 液进行连续实验,实验过程及产物如下:
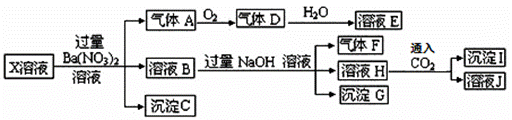
下列说法正确的是( )
A.气体A是NO2
B.X中肯定存在Fe2+、A13+、NH4+、SO42―
C.溶液E和气体F不能发生化学反应
D.X中不能确定的离子是 A13+和C1―
查看答案和解析>>
科目:高中化学 来源: 题型:
对溴甲苯是合成农药溴螨酯的重要原料。工业用液溴、甲苯与1-丙醇共热合成对溴甲苯和1-溴丙烷,其原子利用率很高。实验室模拟的合成流程和相关数据如下:已知:甲苯与溴在有水存在时能反应。
| 物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 |
| 沸点℃ | 110.8 | 97.2 | 71 |
| 物质 | 对溴甲苯 | 邻溴甲苯 | |
| 沸点℃ | 184.3 | 181.7 |
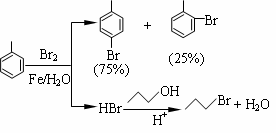
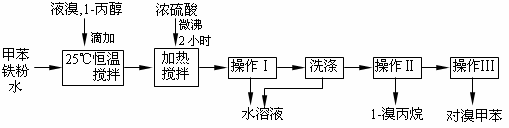
(1)液溴的颜色是__ __ __,实验室存放液溴时应密闭保存,同时需要在试剂瓶中加__ ___,以减少挥发。
(2)25℃恒温搅拌至溴的颜色完全褪去时完成甲苯的溴代反应。搅拌的目的是__________。加入水的作用是:易于控制温度;____________________。
(3)加热搅拌操作中加入浓硫酸,搅拌,完成1-丙醇的取代反应,加入浓硫酸的作用是___ ___,加热微沸2小时的目的是_______ _____。
(4)操作Ⅰ的名称是___________,洗涤操作应在_________(填写仪器名称)中进行。
(5)经以上分离操作后,粗对溴甲苯中还含有的最主要杂质为________(填写名称),使用操作Ⅱ分离出1-溴丙烷的原理是______________________________________。
(6)分离出的水溶液中含HBr、H2SO4和Fe3+离子,将水溶液稀释定容至1000mL,取20.00mL,加入几滴甲基橙作指示剂,用一定浓度的NaOH溶液滴定,测定出HBr的物质的量明显低于理论值,原因是_____________________;有同学认为无需加入指示剂,也能完成滴定,提出这一观点的理由是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作或原理不正确的是( )
|
| A. | 纸层析法中的展开剂之所以能够展开的主要原理是毛细现象 |
|
| B. | 分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒 |
|
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
|
| D. | 测定溶液pH的操作:将pH试纸置于表面皿上,用玻璃棒蘸取溶液,点在pH试纸的中部,与对应的标准比色卡比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A是周期表中原子半径最小的元素;B元素的最高价氧化物的水化物与其氢化物能相互反应生成盐;C元素与A元素可形成两种液态化合物,其原子个数比分别为1 : 1和1 : 2,且分子中电子总数分别为18和10;D元素的主族序数等于其周期数;E元素原子的最外层电子数是其电子层数的2倍。
试回答下列问题:
(1)D元素的原子结构示意图 ;E元素在周期表中位置 。(2)实验室中制取B的氢化物的反应方程式为: 。
B元素的最高价氧化物的水化物与其氢化物能相互反应,其反应生成盐中所含的化学键是 键,实验室中常将B的最高价氧化物的水化物的浓溶液低温保存在棕色试剂瓶中,其原因是 ;工业上储存和运输这种浓溶液,常使用D元素制成的容器,这是因为: 。
(3)C、D、E三种元素的原子半径由大到小的顺序是 (填元素符号);C和E两种元素相比较,非金属性较强的是(填元素名称):
,可以说明该结论的事实是 。(举例一条)
(4)D的单质在工业上常用于焊接钢轨,反应的方程式可表示为:
;D的氢氧化物具有两性,
证明其具有这种性质的反应的离子方程式可表示为:
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com