
某pH=1的X溶液中可能含有Fe2+、A13+、NH4+、CO32―、SO32―、SO42―、C1―中的若干种,现取X溶 液进行连续实验,实验过程及产物如下:
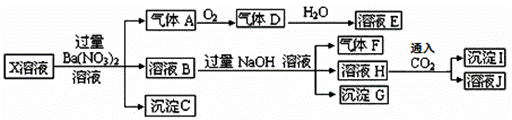
下列说法正确的是( )
A.气体A是NO2
B.X中肯定存在Fe2+、A13+、NH4+、SO42―
C.溶液E和气体F不能发生化学反应
D.X中不能确定的离子是 A13+和C1―
【答案】D
【解析】
试题分析:A、pH=1的溶液是酸性溶液,酸性溶液中不可能大量存在CO32-、SO32-,加入过量硝酸钡溶液,则溶液中含有硝酸,有气体生成,说明该气体是硝酸的还原产物NO,所以A是NO气体,错误;B、原溶液中和硝酸发生氧化还原反应的只能是Fe2+,则原溶液中含有Fe2+,所得沉淀C是硫酸钡沉淀,则原溶液中存在SO42-,溶液B中加入过量氢氧化钠溶液由气体产生,则该气体F是氨气,原溶液中含有NH4+,溶液B中含有铁离子,所以沉淀H是氢氧化铁沉淀,通入二氧化碳气体产生沉淀,因为二氧化碳的量未知,所以产生的沉淀I可能是碳酸钡沉淀,则原溶液中Al3+不能确定,错误;C、溶液E是二氧化氮与水反应的产物硝酸,硝酸与气体F氨气可以反应生成硝酸铵,错误;D、根据以上分析,X中不能确定的离子是 A13+和C1―,正确,答案选D。
考点:考查溶液中离子的判断


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2.已知该反应中H2O2只发生如下过程:H2O2  O2
O2
(1)该反应中的还原剂是
(2)该反应中,发生还原反应的过程是 
(3)写出该反应的化学方程式,并用双线桥法标出电子转移的方向和数目:
(4)若反应转移了0.3mol电子,则产生的气体在标准状况下体积为 L
查看答案和解析>>
科目:高中化学 来源: 题型:
碳酸铜和碱式碳酸铜均可溶于盐酸,转化为氯化铜。在高温下这两种化合物均能分解成氧化铜。溶解28.4 g上述混合物,恰好消耗1mol/L盐酸500mL。灼烧等质量的上述混合物,得到氧化铜的质量是( )
g上述混合物,恰好消耗1mol/L盐酸500mL。灼烧等质量的上述混合物,得到氧化铜的质量是( )
A.35g B.30 g C.20 g D.15 g
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项叙述中不正确的是( )
A.10 ℃ 时NaCl溶解度为35.7g,则此时饱和NaCl 溶液的质量分数小于35.7 %
B.向Na2CO3溶液中加入少量NaHCO3 固体,溶液pH 减小
C.50mL 1.0 mol·L-1盐酸与60 mL 1.0 mol·L-1盐酸分别跟50 mL 1.1 mol·L-1NaOH溶液进行反应,中和热数值不相等
D.一定条件下,向水中加入少量NaHSO4,可使水的电离程度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越越成为人们研制绿色原电池的关注焦点。其中一种镁原电池的反应为:
x Mg+Mo3S4 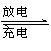
 Mgx Mo3S4 。下列说法错误的是( )
Mgx Mo3S4 。下列说法错误的是( )
A.放电时Mg2+向正极迁移
B.充电时阳极反应为:Mo3S42x-—2xe =Mo3S4
C.充电时Mo3S4发生氧化反应
D.放电时负极反应为:xMg 2xe = xMg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去)。已知A、B为气态单质,F是地壳中含量最多的金属元素的单质,E、H、I为氧化物,E为黑色固体,I为红棕色气体,M为红褐色沉淀。
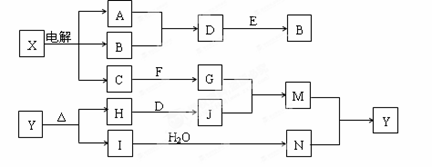
请回答下列问题:(1)B中所含元素位于周期表中第 周期 族。
(2)A在B中燃烧的现象是 。
(3)D + E → B的反应中,被氧化与被还原的物质的量之比是 。
(4)G + J → M的离子方程式是 。
(5)Y受热分解的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O=2NO+HNO3+9HF,下列有关该反应的说法正确的是
A. NF3是氧化剂,H2O是还原剂
B.若生成1 mol HNO3,则转移2mol电子
C.还原剂和氧化剂的物质的量之比是2:1
D.每消耗0. 2 mol氧化剂,可收集到5.418L气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com