
在下列溶液中,各组离子一定能够大量共存的是
A.常温下水电离出的c(OH-)=10-13的溶液中:Na+、ClO-、F-、K+
B.能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br-
C.含有大量Al3+的溶液:Na+、Cl-、S2-、OH-
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO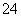 、S2-、SO
、S2-、SO
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
某溶液中可能存在Al3+、Cl-、Mg2+、Na+ 、 Br-、CO32-、SO32-等七种离子中的几种。现取该溶液进行实验,得到如下现象:
①向该溶液中滴加足量氯水后有无色无味气体产生,再加入CCl4振荡,下层液体呈红棕色;②取上层无色溶液,加入足量Ba(NO3)2溶液,无沉淀产生;
③向所得溶液中继续滴加AgNO3溶液,有不溶于HNO3的白色沉淀产生。
据此可以推断,该溶液中肯定存在的离子是_____________,可能存在的离子是 ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-) ②c(NH4+)>c(OH-)>c(Cl-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白:
(1)若溶液中只溶解一种溶质,则该溶质是 ,上述四种离子浓度的大小顺序为(填序号)________________。
(2)若四种离子的关系符合③,则溶质为 ;
若四种离子的关系符合④,则溶质为 。
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,则下面图象正确的是(填图象符号)________。
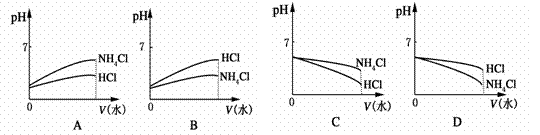
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)________c(NH3·H2O)(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下硝酸铵受热分解的化学方程式为:5NH4NO3 2HNO3+4N2↑+9H2O,在反应中被还原与被氧化的氮原子数之比为
2HNO3+4N2↑+9H2O,在反应中被还原与被氧化的氮原子数之比为
A.5∶4 B.5∶3 C.1∶1 D.3∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
碳酸铜和碱式碳酸铜均可溶于盐酸,转化为氯化铜。在高温下这两种化合物均能分解成氧化铜。溶解28.4 g上述混合物,恰好消耗1mol/L盐酸500mL。灼烧等质量的上述混合物,得到氧化铜的质量是( )
g上述混合物,恰好消耗1mol/L盐酸500mL。灼烧等质量的上述混合物,得到氧化铜的质量是( )
A.35g B.30 g C.20 g D.15 g
查看答案和解析>>
科目:高中化学 来源: 题型:
榴石矿石可以看作CaO、FeO、Fe2O3、A12O3、SiO2组成。工业上对其进行综合利用的流程如下:
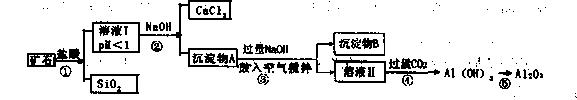
(1)SiO2的用途广泛,试写出其中的一种重要用途 ;
(2)溶液Ⅰ中除了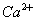 外,还含有的金属阳离子有 ;
外,还含有的金属阳离子有 ;
(3)步骤③中NaOH参加反应的离子方程式是 ,鼓入空气并充分搅拌的目的是 。
(4)在工业生产中,步骤④通入过量CO2而不加入盐酸的原因是
(5)试设计实验证明榴石矿中含有FeO(试 剂任选,说明实验操作与现象)
剂任选,说明实验操作与现象)
查看答案和解析>>
科目:高中化学 来源: 题型:
镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越越成为人们研制绿色原电池的关注焦点。其中一种镁原电池的反应为:
x Mg+Mo3S4 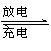
 Mgx Mo3S4 。下列说法错误的是( )
Mgx Mo3S4 。下列说法错误的是( )
A.放电时Mg2+向正极迁移
B.充电时阳极反应为:Mo3S42x-—2xe =Mo3S4
C.充电时Mo3S4发生氧化反应
D.放电时负极反应为:xMg 2xe = xMg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
若以w1和w2分别表示物质的量是浓度为c1 mol•L﹣1和c2mol•L﹣1硫酸溶液的质量分数,已知2w1=w2,则下列推断正确的(硫酸的密度比纯水的大)( )
|
| A. | 2c1=c2 | B. | 2c2=c1 | C. | c2>2c1 | D. | c1<c2<2c1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com