
若以w1和w2分别表示物质的量是浓度为c1 mol•L﹣1和c2mol•L﹣1硫酸溶液的质量分数,已知2w1=w2,则下列推断正确的(硫酸的密度比纯水的大)( )
|
| A. | 2c1=c2 | B. | 2c2=c1 | C. | c2>2c1 | D. | c1<c2<2c1 |
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
在下列溶液中,各组离子一定能够大量共存的是
A.常温下水电离出的c(OH-)=10-13的溶液中:Na+、ClO-、F-、K+
B.能使广泛pH试纸显蓝色的溶液:K+、Ba2+、Cl-、Br-
C.含有大量Al3+的溶液:Na+、Cl-、S2-、OH-
D.能使淀粉碘化钾试纸显蓝色的溶液:K+、SO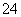 、S2-、SO
、S2-、SO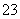
查看答案和解析>>
科目:高中化学 来源: 题型:
对溴甲苯是合成农药溴螨酯的重要原料。工业用液溴、甲苯与1-丙醇共热合成对溴甲苯和1-溴丙烷,其原子利用率很高。实验室模拟的合成流程和相关数据如下:已知:甲苯与溴在有水存在时能反应。
| 物质 | 甲苯 | 1-丙醇 | 1-溴丙烷 |
| 沸点℃ | 110.8 | 97.2 | 71 |
| 物质 | 对溴甲苯 | 邻溴甲苯 | |
| 沸点℃ | 184.3 | 181.7 |
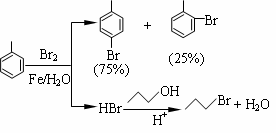
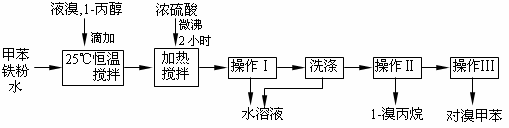
(1)液溴的颜色是__ __ __,实验室存放液溴时应密闭保存,同时需要在试剂瓶中加__ ___,以减少挥发。
(2)25℃恒温搅拌至溴的颜色完全褪去时完成甲苯的溴代反应。搅拌的目的是__________。加入水的作用是:易于控制温度;____________________。
(3)加热搅拌操作中加入浓硫酸,搅拌,完成1-丙醇的取代反应,加入浓硫酸的作用是___ ___,加热微沸2小时的目的是_______ _____。
(4)操作Ⅰ的名称是___________,洗涤操作应在_________(填写仪器名称)中进行。
(5)经以上分离操作后,粗对溴甲苯中还含有的最主要杂质为________(填写名称),使用操作Ⅱ分离出1-溴丙烷的原理是______________________________________。
(6)分离出的水溶液中含HBr、H2SO4和Fe3+离子,将水溶液稀释定容至1000mL,取20.00mL,加入几滴甲基橙作指示剂,用一定浓度的NaOH溶液滴定,测定出HBr的物质的量明显低于理论值,原因是_____________________;有同学认为无需加入指示剂,也能完成滴定,提出这一观点的理由是_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作或原理不正确的是( )
|
| A. | 纸层析法中的展开剂之所以能够展开的主要原理是毛细现象 |
|
| B. | 分液操作时,分液漏斗中的下层液体从下口放出,上层液体从上口倒 |
|
| C. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
|
| D. | 测定溶液pH的操作:将pH试纸置于表面皿上,用玻璃棒蘸取溶液,点在pH试纸的中部,与对应的标准比色卡比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:
欲配制100mL 1.0mol•L﹣1Na2SO4溶液,正确的方法是( )
①将14.2g Na2SO4溶于100mL水中
②将32.2gNa2SO4•10H2O溶于少量水 中,再用水稀释至100mL
③将20mL 5.0mol•L﹣1Na2SO4溶液用水稀释至100mL.
|
| A. | ①② | B. | ②③ | C. | ①③ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中物质的量浓度为1mol/L的是( )
|
| A. | 将40 g NaOH溶解于1 L水中 |
|
| B. | 将22.4 L HCl气体溶解于水配成1 L溶液 |
|
| C. | 将1 L 5 mol/L的盐酸加水稀释至5L |
|
| D. | 将10 g NaOH配制成 250 mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,正确的是
A.太阳能、核能和天然气都属于新型能源
B.哥本哈根气候大会讨论的减排目标主要是控制二氧化硫排放
C.84消毒液具有强氧化性,可杀死流感病毒
D.比黄金还贵的18O2和普通的16O2是两种不同的核素
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A是周期表中原子半径最小的元素;B元素的最高价氧化物的水化物与其氢化物能相互反应生成盐;C元素与A元素可形成两种液态化合物,其原子个数比分别为1 : 1和1 : 2,且分子中电子总数分别为18和10;D元素的主族序数等于其周期数;E元素原子的最外层电子数是其电子层数的2倍。
试回答下列问题:
(1)D元素的原子结构示意图 ;E元素在周期表中位置 。(2)实验室中制取B的氢化物的反应方程式为: 。
B元素的最高价氧化物的水化物与其氢化物能相互反应,其反应生成盐中所含的化学键是 键,实验室中常将B的最高价氧化物的水化物的浓溶液低温保存在棕色试剂瓶中,其原因是 ;工业上储存和运输这种浓溶液,常使用D元素制成的容器,这是因为: 。
(3)C、D、E三种元素的原子半径由大到小的顺序是 (填元素符号);C和E两种元素相比较,非金属性较强的是(填元素名称):
,可以说明该结论的事实是 。(举例一条)
(4)D的单质在工业上常用于焊接钢轨,反应的方程式可表示为:
;D的氢氧化物具有两性,
证明其具有这种性质的反应的离子方程式可表示为:
。
查看答案和解析>>
科目:高中化学 来源: 题型:
某混合气体由N2和CH4组成,测得该混合气体在标准状况下的密度为0.82lg/L,则混合气体中N2和CH4的体积比为( )
A. 1∶1 B. 1∶4 C. 1 ∶ 2 D. 2∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com