
(2)向Na2CO3溶液中逐滴滴入稀盐酸,溶液中的![]() 浓度的变化情况是_______。
浓度的变化情况是_______。
A.逐渐增大 B.逐渐变小
C.先逐渐增大而后减小 D.先逐渐减小后变大
试用离子方程式和简要文字说明理由______________________________。
Ⅱ.已知下列4个反应:
①2Na+2H2O====2NaOH+H2↑
②2F2+2H2O====4HF+O2
③Cl2+H2O====HCl+HClO
④C+H2O![]() CO+H2
CO+H2
试从氧化还原反应的角度,完成下列问题:
(1)水只作氧化剂的是________(填数码代号,下同)。
(2)水只作还原剂的是________。
(3)水既不作氧化剂,又不作还原剂的是________。
科目:高中化学 来源: 题型:
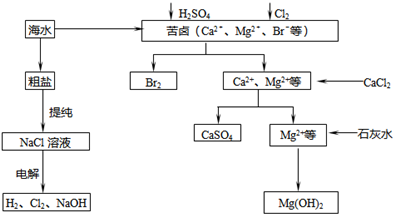 工业上对海水资源综合开发利用的部分工艺流程如图所示.
工业上对海水资源综合开发利用的部分工艺流程如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
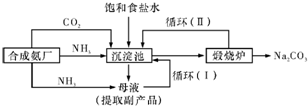 (2011?湖南二模)[化学一选修化学与技术]
(2011?湖南二模)[化学一选修化学与技术]
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com