
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 常温下,23 g NO2含有NA个氧原子
B. 标准状况下,将22.4 L NO和11.2 L O2混合后,可以得到NA个NO2分子
C. 常温常压下,1 L 0. 1mol/L HF溶液中含有0.1NA个H+
D. 0.1 mol的羟基中含有电子的数目为NA
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】请按下列要求填空
I. (1)乙炔的电子式_______________
(2)高聚物![]() 其单体的结构简式为_______________
其单体的结构简式为_______________
(3)  的名称(系统命名法)_____________
的名称(系统命名法)_____________
II.某芳香族化合物的分子式为C7H8O
(4)根据下列实验现象确定其结构简式(要求:每小题只需给出一个答案即可)
①不能与金属钠反应,其结构简式__________________。
②能与钠反应,但遇FeCl3不显色_________________。
③能与钠反应且遇FeCl3显紫色____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是实验操作中,能达到实验目的是( )
A. 用1000mL量筒量取5.2mL盐酸
B. 用电子天平称取25.2250g氯化钠
C. 用100mL容量瓶配制50mL 0.1mol·L-1盐酸
D. 用25.00mL红柄滴定管量取14.80mL NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,碳酸钙在水中的沉淀溶解平衡曲线如图所示,已知25℃时硫酸钙的Ksp=9.1×10-6。下列说法不正确的是

A. 除去锅炉水垢中硫酸钙的办法是将其转化为碳酸钙,然后用酸去除
B. 图中b点碳酸钙的结晶速率大于其溶解速率
C. 通过蒸发,可使溶液由a点变化到c点
D. 在25℃时,反应CaSO4(s)+CO32-(aq)===CaCO3(s)+SO42-(aq)的平衡常数K=3250
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个密闭容器中分别充入Ne、H2、O2三种气体,在以下各种情况下排序正确的是( )
A. 当它们的体积、温度和压强均相同时,三种气体的密度ρ(H2)>ρ(Ne)>ρ(O2)
B. 当它们的温度和密度都相同时,三种气体的压强ρ(H2)>ρ(Ne)>ρ(O2)
C. 当它们的质量、温度和压强均相同时,三种气体的体积V(O2)>V(Ne)>V(H2)
D. 当它们的压强、体积和温度均相同时,三种气体的质量m(H2)>m(Ne)>m(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知拆开1 mol氢气中的化学键需要消耗436 kJ能量,拆开1 mol氧气中的化学键需要消耗498 kJ能量,根据如图中的能量图,回答下列问题:
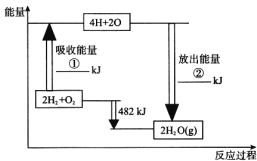
(1)分别写出①②的数值:
①__________;②__________。
(2)生成H2(Xg)中的1 mol H—O键放出__________kJ的能量。
(3)已知:H2O(l)![]() H2O(g)△H=+44 kJ mol1,试写出氢气在氧气中完全燃烧生成液态水的热化学方程式:___________________________________。
H2O(g)△H=+44 kJ mol1,试写出氢气在氧气中完全燃烧生成液态水的热化学方程式:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚是一种清洁能源,用水煤气制取甲醚的原理如下:
I.CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
II.2CH3OH(g)===CH3OCH3(g)+H2O(g)
(1)300℃和500℃时,反应I的平衡常数分别为K1、K2,且K1>K2,则其正反应为_______反应(填“吸热”或“放热”)。
(2)在恒容密闭容器中发生反应I:
①下图能正确反映体系中甲醇体积分数随温度变化情况的曲线是______________(填“a”或“b”)。

②下列说法能表明反应已达平衡状态的是____(填标号)。
A.容器中气体的压强不再变化 B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化 D.v正(H2)=2v正(CH3OH)
(3)500K时,在2L密闭容器中充入4 mol CO和8 mol H2,4 min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3) ,则:
① 0~4 min,反应I的v(H2)=______,反应I的平衡常数K=______。
② 反应II中CH3OH的转化率α=_______。

(4)二甲醚燃料电池的工作原理如图听示,则X电极的电极反应式为_______。用该电池对铁制品镀铜,当铁制品质量增加64 g时,理论上消耗二甲醚的质量为_______g(精确到0.01)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】符合如图所示的转化关系,且当X、Y、Z的物质的量相等时,存在焓变ΔH=ΔH1+ΔH2。满足上述条件的X、Y可能是

①C、CO ②S、SO3 ③Na、Na2O
④AlCl3、Al(OH)3 ⑤Fe、Fe(NO3)2 ⑥NaOH、Na2CO3
A.①④⑤ B.①②③ C.①③④ D.①③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com