
����Ŀ��Ԫ�����ڱ�����ʽ���ֶ�������ͼ������Ԫ�����ڱ���һ���֣��Ա���ѧ����Ԫ�����ڱ���˼������Ԫ�����ڱ��������ɣ��ش���������:
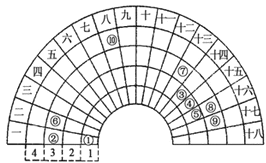
(1)д�����ڳ�ʽ���ڱ��е�λ��______________��
(2)Ԫ�آ͢ߵ�ԭ���������________��
(3)Ԫ�آڢݢ��γɵļ����Ӱ뾶��С�����˳����__________��
(4)Ԫ�آ٢ݿ����γɶ���10���Ӻ�18���ӵ����ӣ�д�����з�������Ҫ������ӵĵ���ʽΪ:4��18���ӵķ���________��10���ӵ�������__________��
���𰸡� �������ڵ�VIII�� 1 Na+��O2-��S2- ![]()
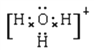
����������������������Ԫ�����ڱ��Ľṹ�����жϳ��١����Ԫ�����ƣ�Ȼ����Ԫ�������ɺ�����е�������������ɡ�
��⣺��������Ԫ�����ڱ��Ľṹ��֪�١���ֱ���H��Na��C��N��O��Mg��Al��S��Cl��Fe����
(1)��������ԭ��������26���ڳ�ʽ���ڱ��е�λ���ǵ������ڵ�VIII�塣
(2)Ԫ�آ͢ߵ�ԭ�������ֱ���12��13�����1��
(3)���ӵĺ�����Ӳ���Խ�࣬���Ӱ뾶Խ��������Ų���ͬʱ���Ӱ뾶��ԭ�������Ķ���С����Ԫ�آڢݢ��γɵļ����Ӱ뾶��С�����˳����Na+��O2-��S2-��
(4)Ԫ��H��O�γ�4��18���ӵķ�����˫��ˮ������ʽΪ![]() ��10���ӵ���������ˮ�������ӣ�����ʽΪ
��10���ӵ���������ˮ�������ӣ�����ʽΪ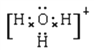 ��
��


 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Na2CO3��NaHCO3��������ȷ����
A. Na2CO3�����մ�NaHCO3��������
B. ����ʱ��NaHCO3��Na2CO3���ֽ�
C. Na2CO3��Һ�Լ��ԣ�NaHCO3��Һ������
D. Na2CO3��NaHCO3��lmol�ֱ��������������ַ�Ӧ������CO2���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣�����ÿ�����ֱ�Ŵ���һ�ֶ�����Ԫ�ء�
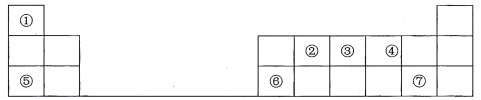
�밴Ҫ��ش��������⣺
��1��Ԫ�آٵ�Ԫ�ط�����___________��Ԫ�آڵ�Ԫ��������_____________��
��2��Ԫ�آݴ������ڱ��е�____________���ڵ�________________�塣
��3���١�������Ԫ����ԭ�Ӱ뾶�������_______________ (��Ԫ�ط���)���ڢۢ�����Ԫ�ص�����⻯�������ȶ�����___________________(�ѧʽ)��
��4��Ԫ�آۺ�Ԫ�آߵ��⻯�����������ˮ���Ҷ����ܷ�Ӧ�����������̣�д���÷�Ӧ����ѧ����ʽ_________________________________________________________________��
��5��Ԫ�آ�����������Ӧ��ˮ������һ��__________�����������������Ԫ����������������Ӧˮ���ﷴӦ�����ӷ���ʽΪ______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������֧�Թ��У���������ֽ���������Ļ�ѧ��Ӧ���������ǣ�������
�Թ� | �¶� | ��������Ũ�� | ���� |
A | ���£�25�棩 | 12% | �� |
B | ˮԡ���ȣ�50�棩 | 4% | �� |
C | ˮԡ���ȣ�50�棩 | 12% | �� |
D | ���£� 25�棩 | 4% | �� |
A.A
B.B
C.C
D.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20 mL 0.1 mol/L��K2CO3��Һ����μ���0.1 mol/L��ϡ����40 mL,��Һ�к�̼Ԫ�صĸ�����(CO2���ݳ�δ����)�����ʵ�����������ҺpH�仯���������ͼ��ʾ������˵����ȷ����

A. ����ϡ����ļ��룬��Һ��![]() ���ֲ���
���ֲ���
B. ����A����㣬Ka2 (H2CO3)��������Ϊ10-3
C. B ����������Һ�У�c(K+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
D. ��pHԼΪ8ʱ����Һ�п�ʼ�ų�CO2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ����У������ɽ���������ֱ�ӻ����Ƶã������ɽ��������ᷴӦ�Ƶõ���
A.MgCl2B.FeCl2C.CuCl2D.FeCl3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ֱ��ʾ�йط�Ӧ�ķ�Ӧ�����������仯�Ĺ�ϵ��


�ݴ��ж�����˵������ȷ����(����)
A. ʯīת��Ϊ���ʯ�����ȷ�Ӧ B. ���ױȺ����ȶ�
C. S(g)��O2(g)===SO2(g)����H1S(s)��O2(g)=SO2(g)����H2������H1>��H2 D. CO(g)��H2O(g)=CO2(g)��H2(g)����H>0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���黯�أ�GaAs���������İ뵼����ϣ������������ͼ�������̫���ܵ�صIJ��ϵȣ��ش��������⣺
��1��д����̬Asԭ�ӵĺ�������Ų�ʽ ��
��2������Ԫ�������ɣ�ԭ�Ӱ뾶GaAs����һ������GaAs��������ڡ���С�ڡ���
��3��AsCl3���ӵ����幹��Ϊ �� ����As���ӻ��������Ϊ ��
��4��GaF3���۵����1000�棬GaCl3���۵�Ϊ77.9�棬��ԭ���� ��
��5��GaAs���۵�Ϊ1238�棬�ܶ�Ϊ�� gcm��3 �� �侧���ṹ��ͼ��ʾ���þ��������Ϊ �� Ga��As�������ϣ�Ga��As��Ħ�������ֱ�ΪMGa gmol��1��MAs gmol��1 �� ԭ�Ӱ뾶�ֱ�ΪrGa pm��rAs pm������٤������ֵΪNA �� ��GaAs������ԭ�ӵ����ռ��������İٷ���Ϊ �� 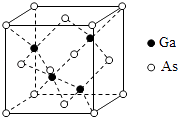
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ĺ��ɣ����뽨���ڲ����������ӽṹ�Ļ����ϣ����й������ϸ���ķ��ӵ�˵������ȷ���ǣ� ��
A. ϸ���еĴ���ӻ��������̼��Ϊ�Ǽܣ����̼��ϸ���ں�������Ԫ��
B. ϸ���е�֬�ʷ��ӵ����ĺ���ԶԶ�������࣬����ĺ�������
C. ��С��ϸ���ڼ�ij������ķ���ʽΪC12H22O11��������������
D. �������ڵ��������ӣ����뱣��һ�������������ά��ϸ�������ƽ��dz���Ҫ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com