
【题目】侯德榜确定的联合制碱法又称侯氏制碱法,侯氏制碱法提高了食盐的转化率,缩短了生产流程,减少了对环境的污染,将制碱技术发展到了一个新的水平,贏得了国际化工界的高度评价。某学习小组按下列实验流程制备![]() 和
和![]() ,设计的部分装置如图所示。
,设计的部分装置如图所示。
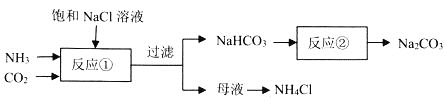
下列说法正确的是![]()
![]()
A.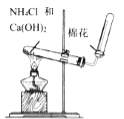 可用装置及所给试剂制备
可用装置及所给试剂制备![]()
B.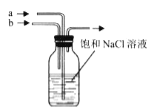 可先a先通入
可先a先通入![]() 至饱和,再由b通入
至饱和,再由b通入![]() 至饱和
至饱和
C.可由蒸发母液至出现大量晶体时,停止加热,利用余热蒸干得到纯净的![]()
D.可用![]() 溶液检验反应
溶液检验反应![]() 是否完全
是否完全
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】为测定某有机物的结构,用核磁共振仪处理后得到如图所示的核磁共振氢谱,则该有机物可能是()
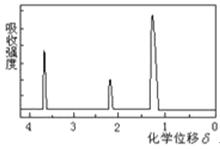
A.C2H5OH
B.![]()
C.CH3CH2CH2COOH
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境问题已成为全球普遍的热门话题。
(1)利用甲烷催化还原氨氧化物。已知:CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g) △H1=-867kJmol-1,CH4(g) +4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H2=-574kJmol-1,则CH4将NO还原为N2的热化学方程式为___。
(2)用NH3催化还原NOX也可以消除氮氧化物的污染.如图采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为:NO(g) +NO2(g) +2NH3(g) 2N2(g)+3H2O(g)。
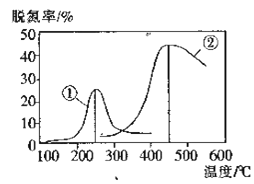
①该反应的△S___0,△H___0(填“>”、“=”或“<”)。
②对于气体反应,用某组分(B)的平衡压强(pB )代替物质的量浓度(cB)也可以表示平衡常数(记作Kp),则上述反应的Kp=______。
③以下说法正确的是___(填标号)。
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
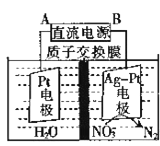
(3)催化反硝化法和电化学沉解法可用于治理水中硝酸盐的污染。
①催化反硝化法中,用H2能NO3-还原为N2,一段时间后,溶液的碱性明显增强,则反应离子方程式为____。
②电化学降解NO3-的原理如图所示。电源正极为______(填A或B),阴极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA(g)≒bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则( )
A.平衡向正反应方向移动了B.物质A的转化率减少了
C.物质B的质量分数减小了D.a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将3molA气体和1molB气体通过一密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)。请填写下列空白:
xC(g)。请填写下列空白:
(1)若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L。
①1min内,B的平均反应速率为_________;x_________;
②若反应经2min达到平衡,平衡时C的浓度_________0.8mol/L(填“大于”、“等于”或“小于”);
③平衡混合物中,C的体积分数为22%,则A的转化率是_________;
(2)若维持容器压强不变
①达到平衡时C的体积分数_________22%,(填“大于”、“等于”或“小于”);
②改变起始物质加入的量,欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入_________molA气体和_________molB气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作达不到预期目的是( )
![]() 用乙醇与3mol/L的H2SO4混合共热制乙烯;
用乙醇与3mol/L的H2SO4混合共热制乙烯;
![]() 将饱和食盐水滴入盛有电石的烧瓶中制乙炔;
将饱和食盐水滴入盛有电石的烧瓶中制乙炔;
![]() 将苯和溴水混合后加入Fe粉制溴苯;
将苯和溴水混合后加入Fe粉制溴苯;
![]() 分馏石油时将温度计的水银球位于蒸馏烧瓶的支管口处,实验室制乙烯则是伸入到混合液中;
分馏石油时将温度计的水银球位于蒸馏烧瓶的支管口处,实验室制乙烯则是伸入到混合液中;
![]() 制硝基苯时,应先加浓硝酸,再加浓硫酸,待液体冷却后再加苯;
制硝基苯时,应先加浓硝酸,再加浓硫酸,待液体冷却后再加苯;
![]() 将
将![]() 与NaOH的醇溶液共热制备CH3-CH=CH2
与NaOH的醇溶液共热制备CH3-CH=CH2
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是

A. 正极反应为AgCl +e-=Ag +Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨是熔点最高的金属,是重要的战略物资。自然界中黑钨矿石的主要成分是铁和锰的钨酸盐(FeWO4、MnWO4),还含少量Si、P的化合物。由黑钨矿冶炼钨的工艺流程如下图:
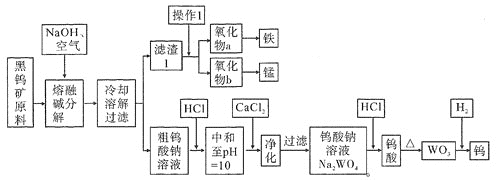
已知:
①滤渣1的主要成份是Fe3O4、MnO2。
②上述流程中,除最后一步外,其余步骤钨的化合价未变。
③常温下,钨酸难溶于水,钨酸钙(CaWO4)微溶于水。
回答下列问题:
⑴钨酸盐(FeWO4、MnWO4)中钨元素的化合价为________,为了加快黑钨矿在空气中熔融碱分解速率,可以采取_____________措施(写出其中一种即可)。
⑵请写出FeWO4在熔融条件下发生碱分解反应生成Fe3O4的化学方程式_________________________。
⑶操作1是工业上分离矿石的一种物理方法,此方法是_____________________________。上述流程中向粗钨酸钠溶液中加HCl调pH = 10后,溶液中的杂质阴离子为SiO32-、PO43-等,则“净化”过程中,加CaCl2的作用是____________________________________________。
⑷磷有两种同素异形体白磷和红磷,白磷有剧毒,不慎沾到皮肤上,可取少量胆矾配制成CuSO4溶液冲洗解毒。白磷可与热的CuSO4溶液反应生成Cu3P(Cu为+1价),反应方程式如下![]() 未配平
未配平![]() 。若反应中被氧化的P4的物质的量为1mol,则反应消耗的CuSO4的物质的量为________。
。若反应中被氧化的P4的物质的量为1mol,则反应消耗的CuSO4的物质的量为________。
CuSO4 + P4 + H2O = Cu3P + H2SO4+ H3PO4(未配平)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g) ![]() 2C(g)+2D(g)在四种不同情况下的反应速率分别为
2C(g)+2D(g)在四种不同情况下的反应速率分别为
①v(A)=0.45 mol·L-1·min-1 ②v(B)=0.6 mol·L-1·s-1 ③v(C)=0.4 mol·L-1·s-1 ④v(D)=0.45 mol·L-1·s-1,该反应进行的快慢顺序为
A. ④>③=②>① B. ④<③=②<① C. ①>②>③>④ D. ④>③>②>①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com