
【题目】下列操作达不到预期目的是( )
![]() 用乙醇与3mol/L的H2SO4混合共热制乙烯;
用乙醇与3mol/L的H2SO4混合共热制乙烯;
![]() 将饱和食盐水滴入盛有电石的烧瓶中制乙炔;
将饱和食盐水滴入盛有电石的烧瓶中制乙炔;
![]() 将苯和溴水混合后加入Fe粉制溴苯;
将苯和溴水混合后加入Fe粉制溴苯;
![]() 分馏石油时将温度计的水银球位于蒸馏烧瓶的支管口处,实验室制乙烯则是伸入到混合液中;
分馏石油时将温度计的水银球位于蒸馏烧瓶的支管口处,实验室制乙烯则是伸入到混合液中;
![]() 制硝基苯时,应先加浓硝酸,再加浓硫酸,待液体冷却后再加苯;
制硝基苯时,应先加浓硝酸,再加浓硫酸,待液体冷却后再加苯;
![]() 将
将![]() 与NaOH的醇溶液共热制备CH3-CH=CH2
与NaOH的醇溶液共热制备CH3-CH=CH2
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
【答案】A
【解析】
①3mol/L的H2SO4不是浓硫酸,不能与乙醇反应生成乙烯,不能达到预期,符合题意,①正确;
②饱和食盐水滴入盛有电石的烧瓶中,反应平稳,可制备乙炔,与题意不符,②错误;
③苯和溴水不反应,则将苯和液溴混合后加入Fe粉制溴苯,不能达到预期,符合题意,③正确;
④分馏时测定馏分的温度,而制备乙烯测定反应液的温度,则分馏石油时将温度计的水银球位于蒸馏烧瓶的支管口处,实验室制乙烯则是伸入到混合液中,与题意不符,④错误;
⑤制硝基苯时,先加密度小的酸,再加密度大的酸,最后加苯,苯易挥发,则制硝基苯时,应先加浓硝酸,再加浓硫酸,待液体冷却后再加苯,与题意不符,⑤错误;
⑥醇与浓硫酸加热发生消去反应,则将![]() 与浓硫酸共热制备CH3-CH=CH2,符合题意,⑥正确;
与浓硫酸共热制备CH3-CH=CH2,符合题意,⑥正确;
综上所述,答案为A。


科目:高中化学 来源: 题型:
【题目】反应3A(s)+3B(g)=2C(g)+D(g),经3 min,B的浓度减少0.9 mol·L-1。对此反应速率的表示正确的是( )
A.用A表示的反应速率是0.4 mol·L-1·min-1
B.分别用B、C、D表示的反应速率之比是3∶2∶1
C.在2 min末的反应速率,用B表示是0.3 mol·L-1·min-1
D.在2 min内的反应速率,用C表示是0.3 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟的单质及其化合物在生产杀虫剂、灭火剂及特种塑料等方面用途广泛。
(1)在2%的氢氧化钠溶液中通入氟气,发生反应:2F2+2NaOH═2NaF+H2O+OF2。该反应氧化剂与还原剂的物质的量之比为____,OF2的电子式为___。
(2)SF6是一种优良的绝缘气体材料,分子结构中只存在S-F键,已知1molS(s)转化为气态硫原子时吸收能量280kJ,形成1molF-F、S-F键需放出的能量分别为160kJ、330kJ,试写出固态S单质和氟气反应生成SF6气体的热化学方程式______。
(3)用含氟牙膏刷牙,氟离子会与牙釉质[主要成分为Ca5(PO4)3OH]发生反应: Ca5(PO4)3OH(s)+F-(aq)![]() Ca5(PO4)3F(s)+OH-(aq),该反应的平衡常数K=_____(已知Ksp[Ca5(PO4)3OH]=7×l0-37,Ksp[Ca5(PO4)3F]=2.8×l0-61)。
Ca5(PO4)3F(s)+OH-(aq),该反应的平衡常数K=_____(已知Ksp[Ca5(PO4)3OH]=7×l0-37,Ksp[Ca5(PO4)3F]=2.8×l0-61)。
(4)聚四氟化烯常用于炊具的“不粘涂层”。制备四氟化烯的反应原理为:2CHClF2(g)![]() C2F4(g)+2HCl(g)△H1(反应I),副反应为:3CHClF(g)
C2F4(g)+2HCl(g)△H1(反应I),副反应为:3CHClF(g)![]() C3F6(g)+3HCl(g)△H2(反应II),反应达到平衡时各气体的物质的量分数随温度的变化如图所示:
C3F6(g)+3HCl(g)△H2(反应II),反应达到平衡时各气体的物质的量分数随温度的变化如图所示:
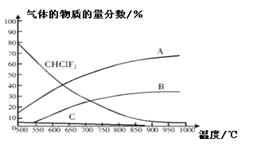
① 在恒温恒容的条件下,下列能够说明反应I达到化学平衡状态的是:_________(填标号)。
A.混合气体密度不再改变 B.混合气体平均相对分子质量不再改变
C.v正(C2F4)=2V逆(HCl) D.c(C2F4)与c(HCl)比值保持不变
② 图中曲线A表示的物质是:______(填化学式)。
③反应2CHClF2(g)![]() C2F4(g)+2HCl(g)的△H_____0(填“>”或“<”)。
C2F4(g)+2HCl(g)的△H_____0(填“>”或“<”)。
④工业上常在900℃以上通过裂解CHClF2来制取C2F4,其原因是______。
(5)25℃时,向amol/L的NaF溶液中滴加等体积bmol/L的盐酸使溶液呈中性(不考虑盐酸与氢氟酸的挥发,忽略溶液体积变化),则HF的电离平衡常数Ka=______。(用含a和b的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃A在一定条件下可以进行如图所示的转化。
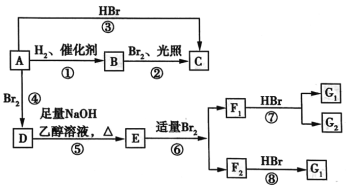
已知:D是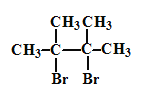 。
。
请填空:
(1)A的结构简式是________,其名称为________。
(2)图中属于取代反应的是________(填数字代号)。
(3)图中①、③、⑥属于________反应。
(4)G1的结构简式是________。
(5)写出由D→E的化学方程式:______;写出由E→F2的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯德榜确定的联合制碱法又称侯氏制碱法,侯氏制碱法提高了食盐的转化率,缩短了生产流程,减少了对环境的污染,将制碱技术发展到了一个新的水平,贏得了国际化工界的高度评价。某学习小组按下列实验流程制备![]() 和
和![]() ,设计的部分装置如图所示。
,设计的部分装置如图所示。
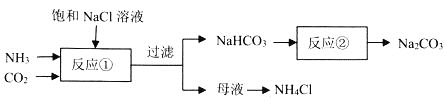
下列说法正确的是![]()
![]()
A.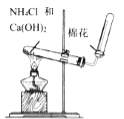 可用装置及所给试剂制备
可用装置及所给试剂制备![]()
B.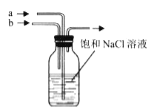 可先a先通入
可先a先通入![]() 至饱和,再由b通入
至饱和,再由b通入![]() 至饱和
至饱和
C.可由蒸发母液至出现大量晶体时,停止加热,利用余热蒸干得到纯净的![]()
D.可用![]() 溶液检验反应
溶液检验反应![]() 是否完全
是否完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3CH2CH2CH2OH→CH3CH2CH2CHO
利用下图装置用正丁醇合成正丁醛。相关数据如下:
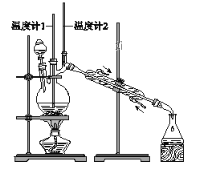
物质 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
下列说法中,不正确的是( )
A. 为防止产物进一步氧化,应将酸化的Na2Cr2O7溶液逐滴加入正丁醇中
B. 向获得的粗正丁醛中加入少量金属钠,检验其中是否含有正丁醇
C. 反应结束,将馏出物倒入分液漏斗中,分去水层,粗正丁醛从分液漏斗上口倒出
D. 当温度计1示数为90~95℃,温度计2示数在76℃左右时,收集产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代传感信息技术在化学实验中有广泛的应用。某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理![]() 如图所示
如图所示![]() ,并测定电离平衡常数Kb.
,并测定电离平衡常数Kb.
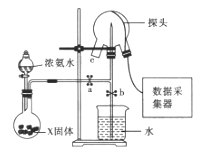
(1)实验室可用浓氨水和X固体制取![]() ,X固体可以是_________;
,X固体可以是_________;
A.生石灰 ![]() 无水氯化钙
无水氯化钙 ![]() 五氧化二磷
五氧化二磷 ![]() 碱石灰
碱石灰
(2)检验三颈瓶集满![]() 的方法是________________________________________。
的方法是________________________________________。
(3)关闭a,将带有装满水的胶头滴管的橡皮塞塞紧c口,______________,引发喷泉实验,电脑绘制三颈瓶内气压变化曲线如图所示。图中 ___点时喷泉最剧烈。
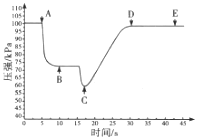
(4)从三颈瓶中用 ____________![]() 填仪器名称
填仪器名称![]() 量取20.00mL氨水至锥形瓶中,用0.05000mol/LHCl滴定。用pH计采集数据、电脑绘制滴定曲线并测定电离平衡常数Kb.
量取20.00mL氨水至锥形瓶中,用0.05000mol/LHCl滴定。用pH计采集数据、电脑绘制滴定曲线并测定电离平衡常数Kb.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛(22Ti)由于其特殊的性能被誉为“未来世纪的金属”。钛铁矿主要成分为FeTiO3(含有少量MgO、SiO2等杂质),Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿来制备,工艺流程如下:
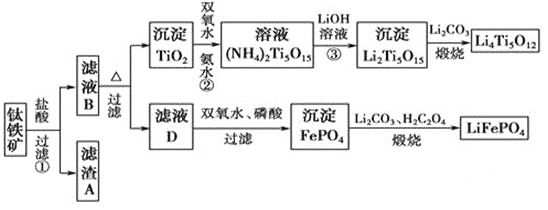
⑴钛铁矿在预处理时需要进行粉碎,其原因是__________________________________。
⑵过程①中,铁的浸出率结果如图所示。由图可知,当铁的浸出率为80%时,所采用的实验条件是_________________________。
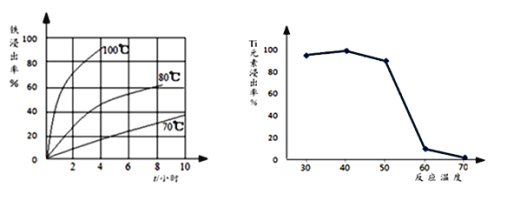
⑶过程②中固体TiO2与双氧水、氨水反应转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度关系如图所示,反应温度过高时,Ti元素浸出率下降的原因是_______________________。
⑷写出由滤液D生成FePO4的离子方程式_____________________________________________
⑸由流程图可知FePO4制备LiFePO4的化学方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[实验化学]
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见下图,相关物质的沸点见附表)。其实验步骤为:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%NaHCO3溶液洗涤。
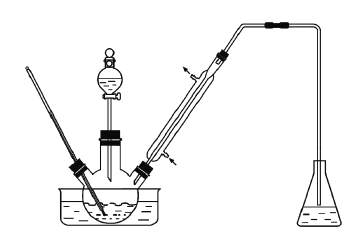
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。
步骤4:减压蒸馏有机相,收集相应馏分。
(1)实验装置中冷凝管的主要作用是________,锥形瓶中的溶液应为________。
(2)步骤1所加入的物质中,有一种物质是催化剂,其化学式为_________。
(3)步骤2中用10%NaHCO3溶液洗涤有机相,是为了除去溶于有机相的______(填化学式)。
(4)步骤3中加入无水MgSO4固体的作用是_________。
(5)步骤4中采用减压蒸馏技术,是为了防止_____。
附表 相关物质的沸点(101kPa)
物质 | 沸点/℃ | 物质 | 沸点/℃ |
溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
苯甲醛 | 179 | 间溴苯甲醛 | 229 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com