
(10分)A~H等8种物质存在如下转化关系(反应条件、部分产物未标出)。已知A是正盐,B是能使品红溶液褪色的气体,G是红棕色气体。按要求回答问题:

(1)写出下列物质的化学式:A ,B 。
(2)写出下列反应的化学方程式:E→F ;
写出下列反应的离子方程式:A→E ;
H的浓溶液与木炭反应的化学方程式: 。
(3)检验某溶液中是否含D中阴离子的方法是 。
(10分)(1)(NH4)2SO3 SO2 (2分) (2)4NH3+5O2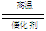 4NO+6H2O (2分)
4NO+6H2O (2分)
NH4++OH-=NH3+H2O (2分)C+4HNO3(浓) 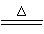 CO2↑+4NO2↑+2H2O (2分)
CO2↑+4NO2↑+2H2O (2分)
(3)取少量该溶液于试管中,加足量盐酸酸化,未见白色沉淀,然后加入氯化钡溶液有白色沉淀,说明含有硫酸根离子(2分)
【解析】
试题分析:(1)B是能使品红溶液褪色的气体,故B是SO2,C是SO3,D是硫酸,G是红棕色气体,根据框图可得G是二氧化氮,F是NO,E是NH3,H是硝酸,A加酸生成了二氧化硫,且A为正盐,故A中含亚硫酸根离子,加碱放出氨气,故A中含铵根离子,故A为亚硫酸铵;(2)E到F是氨气的催化氧化,在催化剂加热得条件下氨气和氧气生成NO和H2O;A到E是铵盐和碱反应,实质是铵根离子和氢氧根离子加热条件下生成氨气和水;碳和浓硝酸反应生成CO2、NO2和H2O;(3)检验硫酸根离子,需先加盐酸酸化,排除亚硫酸根离子和银离子的干扰,再加入氯化钡,有白色沉淀,说明有硫酸根离子。
考点:铵盐的性质、二氧化硫的性质、硫酸根离子的检验等知识。


 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源:2013-2014江苏省徐州市高三考前模拟化学试卷(解析版) 题型:选择题
短周期元素W、X、Y、Z的原子序数依次增大,W与Y原子的最外层电子数之和为X原子的最外层电子数的2倍,Z原子的最外层电子数等于其最内层电子数,X、Y、Z的简单离子的电子层结构相同,W的单质是空气中体积分数最大的气体。下列说法正确的是
A.元素Y的气态氢化物比W的稳定
B.元素Y的最高正价与负价绝对值的和等于8
C.化合物XY2与ZY2分子中的化学键类型相同
D.原子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z)
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省高一下学期5月段考化学必修试卷(解析版) 题型:选择题
苯是重要的有机化工原料。下列关于苯的性质说法正确的是
A.常温常压下为气体 B.易燃
C.不能发生取代反应 D.易溶于水
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省吴江市高二下学期期中考试化学试卷(解析版) 题型:选择题
一定条件下,在体积为10 L的密闭容器中,1 mol A和1 mol B进行反应:2A(g)+B(g) 2C(g),
2C(g),
经60 s达到平衡,生成0.6 mol C。下列说法正确的是
A.以A浓度变化表示的反应速率为0.001 mol·L-1·s-1
B.其他条件不变,将容器体积变为5 L,C的平衡浓度变为原来的2倍
C.其他条件不变,若增大压强,则物质A的转化率减小
D.达到平衡时,C的体积百分含量为0.353
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省吴江市高二下学期期中考试化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.澄清透明溶液中:Cl-、NO3- 、Cu2+ 、NH4+
B.水电离产生的c(OH-)=1×10-11mol/L的溶液:Cu 2+、SO42-、NO3-、Cl-
C.中性溶液中:Fe3+、Al3+、NO3-、SO42-
D.能使苯酚变紫色的溶液:K+、Mg2+、S2-、SO42-
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省吴江市高一下学期期中考试化学试卷(解析版) 题型:选择题
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图。下列有关氢氧燃料电池的说法正确的是

A.该电池工作时电能转化为化学能
B.通入氢气的一极是负极
C.外电路中电子由电极b通过导线流向电极a
D.该电池的总反应:2H2+O2=2H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省吴江市高一下学期期中考试化学试卷(解析版) 题型:选择题
下列各组物质的晶体中,化学键类型和晶体类型都相同的是
A.CO2和H2O B.NaOH和CH4
C.SiO2和CO2 D.NaCl和HCl
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省南通市高三第三次调研测试化学试卷(解析版) 题型:实验题
(12分)硫酸锌被广泛应用于工农业生产和医药领域。工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO4·7H2O的一种流程如下:
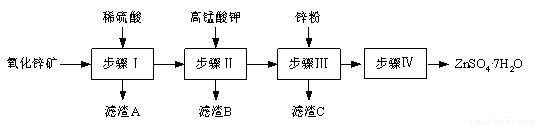
⑴步骤Ⅰ包括酸浸和过滤两个操作。
①酸浸时,需不断通入高温水蒸气的目的是 。
②过滤时,为防止堵塞,过滤装置需经常用氢氧化钠溶液清洗,其清洗原理是
(用化学方程式表示)。
⑵步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为 。
⑶步骤Ⅲ所得滤渣C的主要成分是 。
⑷取28.70 g ZnSO4·7H2O加热至不同温度,剩余固体的质量变化如图所示。
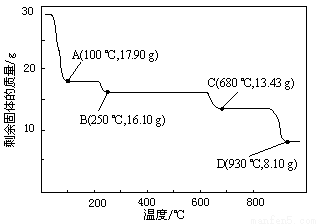
①步骤Ⅳ中的烘干操作需在减压条件下进行,其原因是 。
②680 ℃时所得固体的化学式为 。
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4·H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014江苏省南京市高一下学期期末学情调研测试化学试卷(解析版) 题型:选择题
短周期主族元素W、R、X、Y、Z的原子序数依次增大,且分别占有三个不同的周期。W与X同主族,R与Z同主族,R最外层电子数是其内层电子数的3倍,Y是地壳中含量最多的金属元素。下列说法正确的是
A.W、X是金属元素
B.原子半径:R<Y<Z
C.简单气态氢化物的热稳定性:Z>R
D.X、Y、Z的最高价氧化物对应的水化物能相互反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com