
利用化合价和物质类别推测物质的性质是化学研究的重要手段。
(1)从化合价的角度可以预测物质的性质。
①SO2的性质___________(填序号,下同);
A.只有氧化性 B.只有还原性 C.既有氧化性又有还原性
②将SO2通入酸性KMnO4溶液中,溶液由紫色褪至无色。反应结束后,硫元素存在形式合理的是__________。
A.S2— B.S C.SO32— D.SO42—
(2)从物质分类的角度可以推测物质的性质。现有由MgO、Al2O3、Fe2O3、SiO2组成的某混合物试样。
①其中Al2O3属于_______氧化物,MgO和Fe2O3属于_________氧化物(填“酸性”、“碱性”或“两性”);
②将试样溶于过量的盐酸中,过滤,滤渣的主要成分是_________;再向滤液中加入NaOH溶液至过量,过滤,滤渣中的主要成分是_________;
③若将该试样直接溶于过量的NaOH溶液中,所发生的反应的化学方程式是______________________(可任意写其中一个)。
(1)①C ②D (2)①两性 碱性 ②SiO2 Fe(OH)3、Mg(OH)2
③SiO2 +2NaOH=Na2SiO3+H2O 或 Al2O3 +2NaOH+3H2O=2Na[Al(OH)4]
解析试题分析:(1)①根据氧化还原反应的价态规律:元素处于最高价态只有氧化性,元素处于最低价态只有还原性,元素处于中间价态既有氧化性又有还原性;二氧化硫中硫元素的化合价为+4价,是硫元素的中间价态,所以SO2既有氧化性又有还原性,选C;②将SO2通入酸性KMnO4溶液中,溶液由紫色褪至无色,锰元素的化合价由+7价降为+2价,则硫元素的化合价升高,由+4价变为+6价,选D;(2)①能和碱反应生成盐和水的氧化物是酸性氧化物,能和酸反应生成盐和水的氧化物是碱性氧化物;既能与酸反应,又能与碱反应生成盐和水的氧化物是两性氧化物;Al2O3与盐酸反应生成氯化铝和水,与氢氧化钠溶液反应生成偏铝酸钠和水,属于两性氧化物,MgO与盐酸反应生成氯化镁和水,与碱不反应,Fe2O3与盐酸反应生成氯化铁和水,与碱不反应,属于碱性氧化物;②氧化镁、氧化铝、氧化铁都和盐酸反应生成盐和水,二氧化硅和盐酸不反应,所以滤渣的主要成分是SiO2;镁离子、铁离子和铝离子都能与氢氧根离子反应生成沉淀,但氢氧化铝能和过量的氢氧化钠反应生成可溶性的偏铝酸盐,氢氧化镁和氢氧化铁不与氢氧化钠反应,所以滤渣中的主要成分是Fe(OH)3、Mg(OH)2;③二氧化硅和氧化铝与氢氧化钠溶液反应生成盐和水,氧化镁和氧化铁与氢氧化钠溶液不反应,所以涉及的反应方程式为:SiO2+2NaOH=Na2SiO3+H2O,Al2O3+2NaOH=2NaAlO2+H2O。
考点:考查氧化还原反应、物质的分类及酸性氧化物、碱性氧化物和两性氧化物的概念和性质。


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:填空题
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,两种低价硫化物的化学式分别为________、_______。在反应过程中还有一部分Fe的硫化物转化为低价氧化物,其化学反应方程式为____________。
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量较低。转炉中,将冰铜加熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,,每有1mol氧气参加反应,生成氧化产物的物质的量为_________。生成的Cu2O与Cu2S反应,可制得含Cu量较高的粗铜。
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,c为粗铜板, 则a端应连接电源的_____极(填“正”或“负”),若粗铜中含有Au、Ag、Fe杂质,则电解过程中c电极上发生反应的方程式有__________。
(4)可以应用酸性高锰酸钾溶液滴定法测定反应后电解液中铁元素的含量。滴定时不能用碱式滴定管盛放酸性高锰酸钾溶液的原因是____________,发生反应的离子方程式为_____________,滴定时,锥形瓶中的溶液会接触空气,测得铁元素的含量会____(填“偏高”或“偏低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)请将下列五种物质:KBr、Br2、I2、KI、K2SO4分别填入下列横线上,组成一个未配平的化学方程式:
KBrO3+________+H2SO4―→________+________+________+________+H2O。
(2)如果该化学方程式中I2和KBr的化学计量数分别是8和1,则
①Br2的化学计量数是________;
②请将反应物的化学式及配平后的化学计量数填入下列相应的位置中:
________KBrO3+________+________H2SO4―→……;
③若转移10 mol电子,则反应后生成I2的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃时反应可生成它。CuH具有的性质有:不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是:2Cu+=Cu2++Cu。
根据以上信息,结合自己所掌握的化学知识,回答下列问题:
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中作______(填“氧化剂”或“还原剂”)。
(2)写出CuH在氯气中燃烧的化学反应方程式:________________________。
(3)CuH溶解在稀盐酸中生成的气体是______(填化学式)。
(4)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化学在环境保护中起着十分重要的作用。催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,H2能将NO3-还原为N2。25℃时,反应进行l0 min,溶液的pH由7变为l 2。
①N2的结构式为
②上述反应的离子方程式为 ,其平均反应速率v(NO3-)为 mol·L-1·min-1。
③还原过程中可生成中间产物NO2-,写出2种促进NO2-水解的方法 。
(2)电化学降解NO3-的原理如下图所示。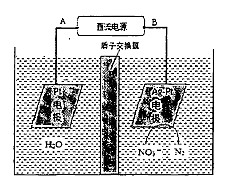
①电源正极为 (填“A”或“B”),阴极反应式为:
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘、镁等。按要求回答下列问题:
(1)可以证明溴比碘的氧化性强的离子反应方程式为____________________________。
(2)从海带灰中提取的碘单质,往往含有一定的杂质,通常利用加热的方法除去杂质,这个过程中主要利用碘性质中的___________,也可以通过萃取分液的方法提取碘,实验室中分液时,分液漏斗中的上层液体应从分液漏斗的_______(填“上”或“下”)口倒出。
(3)点燃的镁条可以在二氧化碳气体中继续燃烧,该反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
次磷酸钠(NaH2PO2)可用于化学镀镍,即通过化学反应在塑料镀件表面沉积镍—磷合金。
(1)化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性条件下发生以下镀镍反应:
① Ni2+ + H2PO2-+ → Ni + H2PO3-+
② 6H2PO2- +2H+ →2P+4H2PO3-+3H2↑
请配平反应式①。
(2)反应式①中还原剂是 ,被还原元素是 。
(3)反应②中,若生成1 mol H2PO3-,反应中转移电子的物质的量为 。
(4)从二个化学镀镍反应分析,若生成1mol Ni和1mol P,同时有 mol H2PO3-生成。
(5)完成下列各小题中的化学反应方程式:碱金属与O2反应生成氧化物较复杂,有普通氧化物(如K2O)过氧化物(如K2O2)还有超氧化物和臭氧化物等。要制备碱金属的普通氧化物一般是用碱金属还原对应的过氧化物、硝酸盐或亚硝酸盐。写出下列化学反应式:
①钠与过氧化钠反应
②钾还原硝酸钾还产生了一种单质气体
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
“神七”登天标志着我国的航天事业进入了新的篇章。
(1)火箭升空时,由于与大气层的剧烈摩擦,产生高温。为了防止火箭温度过高,在火箭一面涂上一种特殊的涂料,该涂料的性质最可能的是 。
| A.在高温下不融化 | B.在高温下可分解气化 |
| C.在常温下就分解气化 | D.该涂料不可能发生分解 |

 CH4(g)+HC≡CH(g)+H2(g); △H1="156.6" kJ·mol-1
CH4(g)+HC≡CH(g)+H2(g); △H1="156.6" kJ·mol-1 CH4(g)+ HC≡CH (g);△H2="32.4" kJ·mol-1
CH4(g)+ HC≡CH (g);△H2="32.4" kJ·mol-1 CH3CH=CH2(g)+H2(g)的△H=_____kJ·mol-1
CH3CH=CH2(g)+H2(g)的△H=_____kJ·mol-1查看答案和解析>>
科目:高中化学 来源: 题型:填空题
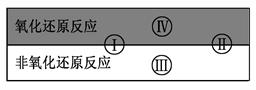
氧化还原反应在生产、生活中具有广泛用途,贯穿古今。
(1)下列生产、生活中的事例中有发生氧化还原反应的是 。(有两个正确选项)
| A.古代活字印刷 | B.原电池工作 | C.简单机械织布 | D.我国古代湿法炼铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com