
【题目】下列说法正确的是( )
A.若丙醇中的氧为188O,它与乙酸反应生成的酯的相对分子质量是104
B.用乙酰水杨酸 ![]() 与适量NaOH溶液反应制备
与适量NaOH溶液反应制备 ![]()
C.向柠檬醛 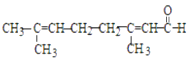 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基
中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基
D.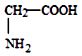 、
、 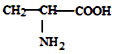 、
、 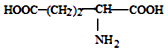 三种氨基酸脱水,最多可生成 6种二肽
三种氨基酸脱水,最多可生成 6种二肽
【答案】A
【解析】解:A.乙酸与丙醇发生酯化反应生成酯和水,羧酸脱﹣OH,醇脱H,2﹣丙醇中的氧为188O,其相对分子质量为62,乙酸的相对分子质量为60,水的相对分子质量为18,由质量守恒定律可知,酯的相对分子质量为62+60﹣18=104,故A正确;B.乙酰水杨酸含有酚羟基和羧基,都具有酸性,都可与氢氧化钠溶液反应,故B错误;
C.有机物含有碳碳双键和醛基,都可与高锰酸钾反应,不能用高锰酸钾检验,故C错误;
D.三种氨基酸脱水,可在相同氨基酸或不同氨基酸之间生成二肽生成二肽种类=3+3×2=9,故D错误.
故选A.
【考点精析】本题主要考查了有机物的结构和性质的相关知识点,需要掌握有机物的性质特点:难溶于水,易溶于汽油、酒精、苯等有机溶剂;多为非电解质,不易导电;多数熔沸点较低;多数易燃烧,易分解才能正确解答此题.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. Na保存在煤油中;溴保存在棕色试剂瓶,并用水封
B. MgO可作耐高温材料
C. Na2CO3常用来治疗人体胃酸过多
D. K-Na合金可作核反应堆的导热剂;Mg-Al合金可用于制造飞机部件
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中的现象及结论均正确的是

A. 锥形瓶中有气体产生,烧杯中液体变浑浊,证明非金属性:Cl>C>Si
B. 形成美丽的红色喷泉,证明HC1极易溶于水
C. 配制一定物质的量浓度的NaOH溶液时,定容时如图观察使配制的NaOH 溶液浓度偏低
D. 只产生红褐色沉定,证明Ksp[Al(OH3)]>Ksp[Fe(OH)3]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究铁、铜及其化合物的性质,某同学设计并进行了下列两组实验。
实验一:
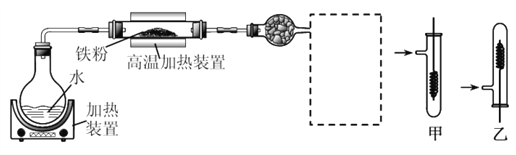
已知:3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)
Fe3O4(s)+4H2(g)
(1)虚线框处宜选择的装置是________(填“甲”或“乙”);实验时应先将螺旋状铜丝加热,变黑后再趁热迅速伸入所制得的纯净氢气中,观察到的实验现象是______________________。
(2)实验后,为检验硬质玻璃管中的固体是否含+3价的铁元素,该同学取一定量的固体并用一定浓度的盐酸溶解,滴加_______溶液(填试剂名称或化学式),没有出现血红色,说明该固体中没有+3价的铁元素。请你判断该同学的结论是否正确并说明理由_________________。
实验二:
绿矾是含有一定量结晶水的硫酸亚铁,为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A 称重,记为m2 g,B为干燥管。按下图连接好装置进行实验。
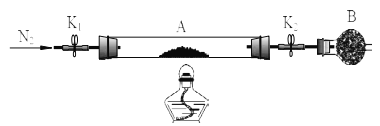
实验步骤如下:(1)________,(2)点燃酒精灯,加热,(3)______,(4)______,(5)______,
(6)称量A, 重复上述操作步骤,直至 A 恒重,记为m3 g。
(3)请将下列实验步骤的编号填写在对应步骤的横线上
a.关闭 K1 和 K2 b.熄灭酒精灯 c.打开 K1 和 K2 缓缓通入 N2 d.冷却至室温
(4)必须要进行恒重操作的原因是_________________。
(5)已知在上述实验条件下,绿矾受热只是失去结晶水,硫酸亚铁本身不会分解, 根据实验记录,
计算绿矾化学式中结晶水数目 x=__________________(用含 m1、 m2、 m3的列式表示)。
【答案】 乙 铜丝由黑变红 硫氰化钾或 KSCN 不正确,因为铁过量时: Fe+2Fe3+→3Fe2+ c b d a 确保绿矾中的结晶水已全部失去 ![]()
【解析】试题分析:实验一:(1)铁与水蒸气反应生成Fe3O4和氢气,虚线框中的装置是用氢气还原氧化铜的装置,根据氢气的密度比空气小分析;氧化铜被氢气还原为铜单质;(2)Fe3+能使KSCN溶液变成血红色;单质铁能把Fe3+还原为Fe2+;
实验二:(3)由于装置中含有空气,空气能氧化硫酸亚铁,所以加热前要排尽装置中的空气,利用氮气排出空气,为使生成的水蒸气完全排出,应该先熄灭酒精灯再关闭K1 和 K2;冷却后再称量;(4)进行恒重操作可以确保绿矾中的结晶水已全部失去;(5)根据题意,生成硫酸亚铁是![]() ,生成水的质量是
,生成水的质量是![]() ,根据
,根据![]() 计算x值;
计算x值;
解析:实验一:(1)铁与水蒸气反应生成Fe3O4和氢气,虚线框中的装置是用氢气还原氧化铜的装置,氢气的密度比空气小,所以用向下排空气法收集氢气,故选乙;氧化铜被氢气还原为铜单质,现象是铜丝由黑变红;(2)Fe3+能使KSCN溶液变成血红色,滴加KSCN溶液检验是否含有Fe3+,若溶液变为血红色,则含有Fe3+;单质铁能把Fe3+还原为Fe2+,当铁过量时: Fe+2Fe3+=3Fe2+,所以没有出现血红色,不能说明该固体中没有+3价的铁元素;
实验二:(3)由于装置中含有空气,空气能氧化硫酸亚铁,所以加热前要排尽装置中的空气,利用氮气排出空气,为使生成的水蒸气完全排出,应该先熄灭酒精灯再关闭K1 和 K2;冷却后再称量,正确的步骤是(1)打开 K1 和 K2 缓缓通入 N2,(2)点燃酒精灯,加热,(3)熄灭酒精灯,(4)冷却至室温,(5)关闭 K1 和 K2,(6)称量A, 重复上述操作步骤,直至 A 恒重,记为m3 g;(4)进行恒重操作可以确保绿矾中的结晶水已全部失去;(5根据题意,生成硫酸亚铁是![]() ,生成水的质量是
,生成水的质量是![]() ,
,
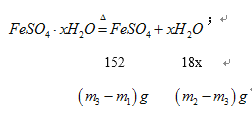
X=![]() 。
。
【题型】实验题
【结束】
24
【题目】PTT 是一种高分子材料,具有优异性能,能作为工程塑料、纺织纤维和地毯等材料而得到广泛应用。其合成路线可设计为:
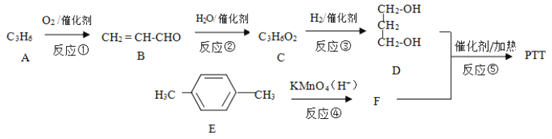
已知: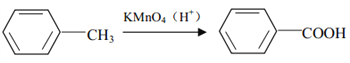
(1)B 中所含官能团的名称为_________,反应②的反应类型为_________。
(2)反应③的化学方程式为_________。
(3)写出 PTT 的结构简式_________。
(4)某有机物X 的分子式为C4H6O,X与B互为同系物,写出X可能的结构简式_________。
(5)请写出以 CH2=CH2 为主要原料(无机试剂任用)制备乙酸乙酯的合成路线流程图(须注明反应条件)。(合成路线常用的表示方式为:![]() )____________
)____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理饮食和正确用药,是人体健康的重要保证. 现有下列五种物质 A.新鲜的橙汁 B.葡萄糖 C.食盐 D.小苏打 E.青霉素,
请按下列要求填空(填序号).
应用最广泛的抗生素之一的是 , 可直接进入血液,补充能量的是 , 既可作为疏松剂,又可治疗胃酸过多的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,喷墨打印机墨汁的pH为7.5~9.0,当墨汁喷在纸上时,与酸性物质作用生成不溶于水的固体.由此可知( ) ①墨汁偏碱性 ②墨汁偏酸性 ③纸张偏酸性 ④纸张偏碱性.
A.①③
B.②④
C.①④
D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2是常见的氧化剂、催化剂和活性电极材料。
(1)工业上,以惰性材料为电极,电解MaSO4溶液(含少量稀硫酸)制备MnO2。写出阳极的电极反应式:_________________________________。
(2)已知如下热化学方程式(K代表平衡常数):
①MnCO3(s)![]() Mn0(s)+CO2(g)△H1 K1
Mn0(s)+CO2(g)△H1 K1
②2MnO(s)+O2(g)![]() 2MnO2(s)△H2 K2
2MnO2(s)△H2 K2
③2MnCO3(n)+O2(g)![]() 2MnO2(s)+2CO2(g)△H3 K3
2MnO2(s)+2CO2(g)△H3 K3
△H3=________用△H1,△H2表示);K3=________用K1、K2表示)。
(3)反应②在低温条件下能自发进行,则△H3________0(填“>"“<"或“=")。
(4)在密闭容器中投入足量的MnCO3,一定条件下发生反应MnCO3(s)![]() MnO(s)+CO2(g) △H>0。在一定湿度下,达到平衡状态时ρ(CO2)=2aMPa。
MnO(s)+CO2(g) △H>0。在一定湿度下,达到平衡状态时ρ(CO2)=2aMPa。
①温度、压强对MnCO3分解率的影响如图所示:
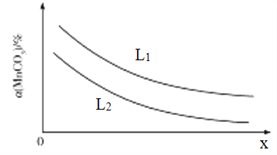
比较:L1__________L2(填“>"“<”或“=")。
②保持温度不变,将容器休积扩大至原来的2倍,则ρ(CO2)的变化范围是____________。
③保持温度不变,将容器体积压缩至原来的一半,达到新平衡时下列物理量一定不变的是____(填代号)。
A.平衡常数K B.c(CO2) C.n(CO2) D.m(MnCO3)
(5)一定温度下,在容积为2L的恒容密闭容器中加入足量的MnCO3(s)和5molO2,发生反应:2MnCO3(s)+O2(g)![]() 2MnO2(s)+2CO2(g),CO2以平均速率为0.1mol·L-1·min-1经过10min达到平衡状态,该条件下该反应的平衡常数K为______________。
2MnO2(s)+2CO2(g),CO2以平均速率为0.1mol·L-1·min-1经过10min达到平衡状态,该条件下该反应的平衡常数K为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com