
【题目】下列说法正确的是
A.最外层都只有2个电子的元素原子性质一定相似
B.同一周期元素中,第一电离能随原子序数增加而增大
C.I3AsF6晶体中存在I3+离子,I3+离子的几何构型为V形
D.H2O2是一种含有极性键和非极性键的非极性分子
科目:高中化学 来源: 题型:
【题目】过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量。请回答下列问题:
(1)移取10.00 mL密度为ρg·mL-1的过氧化氢溶液至250mL______(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00 mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,请写出其反应的离子方程式_______。
(3)滴定时,将高锰酸钾标准溶液注入_______(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是________。
(4)重复滴定三次,平均耗用c mol·L-1KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为_________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_______(填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】托盘天平、容量瓶、量筒是常见的中学化学计量仪器,熟知这些仪器的使用是定量研究化学的基础。
(1)下列操作中,容量瓶所不具备的功能有________________ (填序号)。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液 C.测量容量瓶规格以下的任意体积的溶液 D.准确稀释某一浓度的溶液 E.量取一定体积的液体 F.用来加热溶解固体溶质
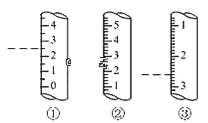
(2)如图是某些仪器的刻度部分示意图,图中各仪器虚线为所示读数。其中为量筒的是_______ (填编号),读数为_____mL。
(3)实验室用98%的浓硫酸配制(浓硫酸的密1.84g/mL)450mL 0.1 mol·L-1的硫酸。回答下列问题:
①配制中应选用的玻璃仪器除量筒、烧杯、玻璃棒、还有___________,应量取________mL 98%的浓硫酸。
②对浓硫酸稀释过程中遇到下列情况,使所配制的硫酸浓度大于0.1mol/L有_____(填序号)
A.未经冷却趁热将溶液注入容量瓶中
B.摇匀后发现液面低于刻度线,再加水至刻度线
C.容量瓶中原有少量蒸馏水
D.定容时俯视观察液面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常用AG表示溶液的酸碱度,AG=![]() 。25℃,用0.100mol·L-1NaOH液滴定20.00 mL 0.100 mol·L-1 HNO2溶液, AG与所加NaOH溶液的体积(V)关系如图所示。下列说法不正确的是
。25℃,用0.100mol·L-1NaOH液滴定20.00 mL 0.100 mol·L-1 HNO2溶液, AG与所加NaOH溶液的体积(V)关系如图所示。下列说法不正确的是
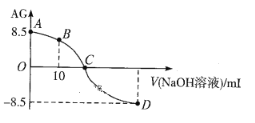
A. D点溶液中的pH=11.25
B. B点溶液中存在2c(H+)-2c(OH-)=c(NO2-)-c(HNO2)
C. C点时,加入NaOH溶液的体积小于20.00 mL
D. 25℃时,HNO2的电离平衡常数Ka=1.0×10-5.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关说法正确的是
A.常温常压下,1.8g甲基(—CD3)中含有的电子数为NA
B.0. lmol环氧乙烷(![]() )中含有的共价键数为0. 3 NA
)中含有的共价键数为0. 3 NA
C.常温下,1L pH=9的CH3COONa溶液中,发生电离的水分子数为1×10-9 NA
D.加热条件下,含0.2molH2SO4的浓硫酸与足量铜反应,转移电子数小于0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)PM2.5分散在空气中形成的分散系________(填“属于”或“不属于”)胶体。
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度/ mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断待测试样为________(填“酸”或“碱”)性,表示该试样酸碱性的c(H+)或c(OH-)=________mol·L-1。
(3)为减少SO2的排放,可用某些溶液洗涤含SO2的烟气。以下物质可做洗涤剂的是__________________________(填字母)。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(4)汽车尾气中NOx和CO的生成及转化。
①汽车启动后,汽缸温度越高,单位时间内NO排放量越大,写出汽缸中生成NO的化学方程式:_____________________________。
②汽车燃油不完全燃烧时产生CO,目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3个体积均为4.0 L的恒容密闭容器中,反应 CO2(g)+C(s)![]() 2CO(g) ΔH > 0,分别在一定温度下达到化学平衡状态。下列说法正确的是
2CO(g) ΔH > 0,分别在一定温度下达到化学平衡状态。下列说法正确的是
容器 | 温度/K | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(CO2) | n(C) | n(CO) | n(CO) | ||
I | 977 | 0.56 | 1.12 | 0 | 0.8 |
II | 977 | 1.12 | 1.12 | 0 | x |
III | 1250 | 0 | 0 | 1.12 | y |
A.977 K,该反应的化学平衡常数值为4
B.达到平衡时,向容器I中增加C的量,平衡正向移动
C.达到平衡时,容器I中CO2的转化率比容器II中的大
D.达到平衡时,容器III中的CO的转化率大于28.6%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li-SO2充电电池具有高输出功率的优点。多孔碳电极可吸附SO2,电解液为溶解有LiBr的碳酸丙烯酯-乙腈溶液。下列说法错误的是( )
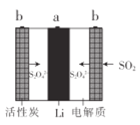
A.活性炭具有加快放电速率的作用
B.放电时,电子流向:a→溶液→b→a
C.充电时,阳极上发生的电极反应为:S2O42--2e-=2SO2
D.该电池的电解质溶液不能换成LiBr的水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸和铜在加热时反应,生成SO2气体的体积为3.36L(标准状况下)。已知:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。试计算:(写出计算过程)
CuSO4+SO2↑+2H2O。试计算:(写出计算过程)
(1)SO2气体的物质的量是多少?___
(2)参加反应的硫酸的物质的量是多少?___
(3)将生成的硫酸铜配制成500mL溶液,则该溶液中溶质的物质的量浓度是多少?___
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com