
����Ŀ��������ƽ������ƿ����Ͳ�dz�������ѧ��ѧ������������֪��Щ������ʹ���Ƕ����о���ѧ�Ļ�����
(1)���в����У�����ƿ�����߱��Ĺ�����________________ (�����)��
A.����һ�����ȷŨ�ȵı���Һ B.������Һ C.��������ƿ������µ������������Һ D.ȷϡ��ijһŨ�ȵ���Һ E.��ȡһ�������Һ�� F.���������ܽ��������
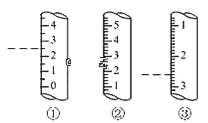
(2)��ͼ��ijЩ�����Ŀ̶Ȳ���ʾ��ͼ��ͼ�и���������Ϊ��ʾ����������Ϊ��Ͳ����_______ (����)������Ϊ_____mL��
(3)ʵ������98%��Ũ��������(Ũ�������1.84g/mL)450mL 0.1 mol��L-1�����ᡣ�ش��������⣺
��������Ӧѡ�õIJ�����������Ͳ���ձ���������������___________��Ӧ��ȡ________mL 98%��Ũ���ᡣ
�ڶ�Ũ����ϡ�������������������ʹ�����Ƶ�����Ũ�ȴ���0.1mol/L��_____(�����)
A.δ����ȴ���Ƚ���Һע������ƿ��
B.ҡ�Ⱥ���Һ����ڿ̶��ߣ��ټ�ˮ���̶���
C.����ƿ��ԭ����������ˮ
D.����ʱ���ӹ۲�Һ��
���𰸡�BCDEF �� 2.6 ��ͷ�ιܡ�500mL����ƿ 2.7 AD
��������
��1������ƿ��Ϊ��������������������һ�����ʵ���Ũ�ȵ���Һ����Ҫ�������������ڴ�����ܽ⡢ϡ�����ʣ�Ҳ���ܲ��������������ݻ���Һ�������
��2����ͼ�и��������Ŀ̶��ص㣬��֪��Ϊ��Ͳ������Ϊ2.6mL��
��3���ٸ���ϡ��ʽ����ͽ��
�ڸ���c=![]() �������жϡ�
�������жϡ�
��1������ƿ��Ϊ��������������������һ�����ʵ���Ũ�ȵ���Һ����Ҫ�������������ڴ�����ܽ⡢ϡ�����ʣ�Ҳ���ܲ��������������ݻ���Һ���������������ƿ���߱��Ĺ����У�BCDEF���ʴ�Ϊ��BCDEF��
��2����ͼ�и��������Ŀ̶��ص㣬��֪��Ϊ��Ͳ������Ϊ2.6mL���ʴ�Ϊ���ڣ�2.6��
��3��������450mL 0.1 mol��L-1��������Һ��ʵ���У�ѡ�õIJ�����������Ͳ���ձ��������������н�ͷ�ιܡ�500mL����ƿ������450mL 0.1 mol��L-1��ϡ���ᣬ��Ҫ500mL������ƿ��98%��Ũ���ᣨ�ܶ�Ϊ1.84g/mL�������ʵ���Ũ��Ϊ![]() mol/L=18.4mol/L��������Ũ�������ΪV������ϡ�Ͷ��ɣ�ϡ��ǰ�����ʵ����ʵ������䣬��500��0.1mol/L=V��18.4mol/L�����V=2.7mL��
mol/L=18.4mol/L��������Ũ�������ΪV������ϡ�Ͷ��ɣ�ϡ��ǰ�����ʵ����ʵ������䣬��500��0.1mol/L=V��18.4mol/L�����V=2.7mL��
��A. δ����ȴ���Ƚ���Һע������ƿ�лᵼ�¶���ʱ��Һ���ƫС��ʹ�����Ƶ�����Ũ�ȴ���0.1mol/L����A��ȷ��
B. ҡ�Ⱥ���Һ����ڿ̶��ߣ��ټ�ˮ���̶��ᵼ�¶���ʱ��Һ���ƫ��ʹ�����Ƶ�����Ũ��С��0.1mol/L����B����
C. ����ƿ��ԭ����������ˮ��ʵ����û��Ӱ�죬��C����
D. ����ʱ���ӹ۲�Һ��ᵼ�¶���ʱ��Һ���ƫС��ʹ�����Ƶ�����Ũ�ȴ���0.1mol/L����D��ȷ��
��ȷ����AD��


 �¿α�����Ķ�ѵ��ϵ�д�
�¿α�����Ķ�ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Կ��淴Ӧ4NH3(g)��5O2(g) ![]() 4NO(g)��6H2O(g)������������ȷ����(����)
4NO(g)��6H2O(g)������������ȷ����(����)
A. �ﵽ��ѧƽ��ʱ4v��(O2)��5v��(NO)
B. ����λʱ��������x mol NO��ͬʱ������x mol NH3����Ӧ�ﵽƽ��״̬
C. �ﵽ��ѧƽ��ʱ�������������ݻ���������Ӧ���ʼ�С���淴Ӧ��������
D. ��ѧ��Ӧ���ʹ�ϵ��2v��(NH3)��3v��(H2O)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��������������ԭ�����͵���
A. ����������̿�ʹ��λʱ���ڹ�������ֽ����������������
B. ��ҵ�������ᣬͨ������Ŀ�������߶��������ת����
C. ������ˮpH��С
D. Fe(SCN)3��Һ�м���KSCN����ɫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯������;�dz��㷺���ش��������⣺
��1�����ķ���ϩ��Ʒ����Ϊ���ط�������������ճ��Ϳ�㡣����һ�����壬�þ�����һ����ƽ�����������ϸ�����λ����Ķ��ؾ��塣��ͨ��____�������־��塢����ͷǾ��塣
��2����̬�ࣨSb��ԭ�Ӽ۵����Ų��Ĺ��ʽΪ____��[H2F]+[SbF6]���������ࣩ��һ�ֳ�ǿ�ᣬ����[H2F]+�������ӵĿռ乹��Ϊ______������д��һ����[H2F]+������ͬ�ռ乹�ͺͼ�����ʽ�ķ��Ӻ������ӷֱ���_______��_________��
��3�����ᣨH3BO3�����ķ�����泥�NH4BF4����������Ҫ�Ļ�����;��
��H3BO3��NH4BF4�漰������Ԫ���еڶ�����Ԫ�صĵ�һ�������ɴ�С��˳��_____����Ԫ�ط��ţ���
��H3BO3�������ܵ����H+����ˮ�����һ��OH������[B(OH)4]���������������ԡ�[B(OH)4]����Bԭ�ӵ��ӻ�����Ϊ_____��
��NH4BF4���ķ�����泥�����������ͭ�������ۼ����ܸ�ʴ�����ȡ��ķ�������д���_______������ţ���
A ���Ӽ� B ���� C ���� D ��� E ���»���
��4��SF6���㷺������ѹ�����豸��Ե���ʡ�SF6��һ�ֹ��ۻ������ͨ��������Born-Haberѭ��������������ͼ����ͼa����������ϵ�ļ��ܡ���S��F�ļ���Ϊ_______kJ��mol-1��

��5��CuCl���۵�Ϊ426�棬�ۻ�ʱ���������磻CuF���۵�Ϊ908�棬�ܶ�Ϊ7.1g��cm-3��
��CuF��CuCl�۵�ߵ�ԭ����_____________��
�� ��֪NAΪ�����ӵ�������CuF�ľ����ṹ������ͼb������CuF�ľ�������a=__________nm ���г�����ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ�����ӵ�������ֵ������Ϊ����������ƹ㷺Ӧ�����ν�Ⱦ�� ��Ƥ�� ����Ƶȹ�ҵ�����Ƶ�һ���Ʊ�������Na2SO4+2C ![]() Na2S+2CO2���������й�˵����ȷ����
Na2S+2CO2���������й�˵����ȷ����
A.2L0.5mol/L Na2SO4 ��Һ�к��е���ԭ����ĿΪ4NA
B.1 L0.1mo/L Na2S��Һ�к��е���������ĿС��0.1NA
C.���� 0.25mol��ԭ����ʱת�Ƶ�����Ϊ2NA
D.ͨ��״����11.2LCO2�к��еĹ��ۼ���ĿΪ 2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.���з�Ӧ��CO(g)��H2O(g)![]() CO2(g)��H2(g) ��H<0����850��ʱ��K��1��
CO2(g)��H2(g) ��H<0����850��ʱ��K��1��
��1���������¶ȵ�950��ʱ���ﵽƽ��ʱK__________1(����ڡ���С�ڡ����ڡ�)��
��2��850��ʱ������һ�ݻ��ɱ���ܱ�������ͬʱ����1.0 mol CO��3.0 mol H2O��1.0 mol CO2��x mol H2����
�ٵ�x��5.0ʱ������ƽ����_____________(�����Ӧ�����淴Ӧ��)�����ƶ���
����Ҫʹ������Ӧ��ʼʱ������Ӧ������У���xӦ�����������_______________��
��.��һ�̶��ݻ����ܱ�������,����һ���¶�,��һ�������·������·�Ӧ:2A(g)+B(g)![]() 3C(g),��֪����1 mol A��2 mol B�Ҵﵽƽ���,������a mol C��
3C(g),��֪����1 mol A��2 mol B�Ҵﵽƽ���,������a mol C��
��3���ﵽƽ��ʱ,C�ڷ�Ӧ��������е����������___(�ú�a�Ĵ���ʽ��ʾ)��
��4������ͬ��ʵ��������,����ͬһ�����и�Ϊ����2 mol A��4 mol B,�ﵽƽ���,C�����ʵ���Ϊ___mol(�ú�a�Ĵ���ʽ��ʾ)����ʱC�ڷ�Ӧ��������е����������ԭƽ�����___(��������������С������������)��
��5������ͬʵ��������,����ͬһ�����и�Ϊ����2 mol A��5 mol B,��Ҫ��ƽ���C�ڷ�Ӧ��������е������������ԭƽ����ͬ,��Ӧ����___mol C��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.1mol��L1��Ԫ����H2A��Һ�м����������ع���ı���Һ��pH����Һ�е�H2A��HA��A2�����ʵ�������![]() (X)��pH�ı仯��ͼ��ʾ[��֪
(X)��pH�ı仯��ͼ��ʾ[��֪![]() (X) =
(X) =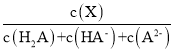 ]�����������������
]�����������������
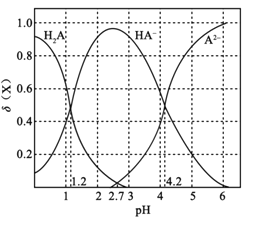
A.pH=1.2ʱ��c(K+)+c(H+)=c(H2A)+c(OH)
B.�����£�H2A�ĵ���ƽ�ⳣ��Ka2=1042
C.pH=2.7ʱ��c(HA)��c(H2A)=c(A2)
D.KHA��Һ������Ũ��Ϊc(K+)��c(HA)��c(OH)��c(H2A)��c(H+)��c(A2)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.����㶼ֻ��2�����ӵ�Ԫ��ԭ������һ������
B.ͬһ����Ԫ���У���һ��������ԭ���������Ӷ�����
C.I3AsF6�����д���I3�����ӣ�I3�����ӵļ��ι���ΪV��
D.H2O2��һ�ֺ��м��Լ��ͷǼ��Լ��ķǼ��Է���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�����ӷ���ʽ��д��ȷ����(����)
A. ����Ͷ��NaOH��Һ�У�2Al��2OH��===2AlO2-��H2��
B. Na��CuSO4��Һ��Ӧ��Cu2����2Na===2Na����Cu
C. ��AlCl3��Һ�м��������İ�ˮ��Al3����3OH��===Al(OH)3��
D. Ba(OH)2��Һ��ϡ���ᷴӦ��Ba2����2OH����2H����SO42-===BaSO4����2H2O
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com