
【题目】莫尔盐[硫酸亚铁铵,(NH4)2Fe(SO4)26H2O,Mr=392]是一种重要的还原剂,在空气中比一般的亚铁盐稳定,易溶于水,难溶于乙醇。某学习小组设计如下实验制备少量的莫尔盐并测定其纯度。

回答下列问题:
Ⅰ.制取莫尔盐
i.连接装置,检査装置气密性。将13.2g(NH4)2SO4晶体置于三颈烧瓶B中,将6.0g洁净铁屑加入锥形瓶中。
ii.打开仪器a瓶塞,关闭活塞K3,打开K2、K1,加完55.0mL2mol·L-1稀硫酸后关闭K1。
iii.待大部分铁粉溶解后,打开K3、关闭K2,A中浅绿色溶液流入B。
iv.关闭活塞K2、K3,采用100℃水浴蒸发三颈烧瓶中水分,液面产生晶膜时,停止加热,冷却结晶、过滤、洗涤晶体。
(1)仪器a的名称是___。
(2)操作iii中浅绿色溶液会流入B的原因是___。
(3)操作iv中洗涤晶体所用试剂是___(填标号)。
A.水 B.无水乙醇 C.硫酸溶液
Ⅱ.为测定所得莫尔盐晶体纯度,取mg该样品配制成1L溶液,分别设计如下两个实验方案,请回答:
方案一:取20.00mL所配硫酸亚铁铵溶液用0.1000mol·L-1的酸性K2Cr2O7溶液进行滴定。重复三次。(已知:Cr2O72-还原产物为Cr3+)
(4)写出此反应的离子方程式___。
(5)滴定时必须选用的仪器是___。(填标号)
方案二:取20.00mL所配硫酸亚铁铵溶液进行如下实验。
![]()
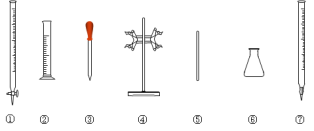
(6)莫尔盐晶体纯度为___。(用含m、w的式子表示)
(7)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为__。
【答案】分液漏斗 A中产生H2使其压强大于B B 6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O ①④⑥ ![]() ×100% 部分Fe2+被空气氧化
×100% 部分Fe2+被空气氧化
【解析】
(1)仪器a的名称是分液漏斗;
(2)A中产生H2使其压强大于B;
(3)摩尔盐易溶于水而难溶于乙醇,洗涤摩尔盐时摩尔盐不能溶解于洗涤剂;
(4)Cr2O72-还原产物为 Cr3+,则K2Cr2O7 具有氧化性,摩尔盐中亚铁离子被氧化生成铁离子,同时还生成水,根据反应物和生成物书写离子方程式;
(5)酸性 K2Cr2O7 溶液具有强氧化性和酸性,应该盛放在酸式滴定管中,所以该实验滴定时需要的仪器有酸式滴定管、滴定管夹、锥形瓶;
(6)得到的沉淀是BaSO4,n(BaSO4)=![]() mol,根据硫酸根离子守恒得(NH4)2Fe(SO4)26H2O~2BaSO4,则n[(NH4)2Fe(SO4)2
mol,根据硫酸根离子守恒得(NH4)2Fe(SO4)26H2O~2BaSO4,则n[(NH4)2Fe(SO4)2![]() 6H2O]=
6H2O]=![]() n(BaSO4)=
n(BaSO4)=![]() mol,m[(NH4)2Fe(SO4)2
mol,m[(NH4)2Fe(SO4)2![]() 6H2O]=
6H2O]=![]() mol×392g/mol×
mol×392g/mol×![]() =
=![]() g,摩尔盐纯度=
g,摩尔盐纯度=![]() ×100%;
×100%;
(7)Fe2+不稳定,易被空气氧化。
(1)仪器a的名称是分液漏斗;
(2)A中产生H2使其压强大于B,液体从压强大的装置流入压强小的装置,所以浅绿色溶液会流入 B;
(3)摩尔盐易溶于水而难溶于乙醇,洗涤摩尔盐时摩尔盐不能溶解于洗涤剂,所以应该选取乙醇洗涤摩尔盐,答案为B;
(4)Cr2O72-还原产物为 Cr3+,则K2Cr2O7 具有氧化性,摩尔盐中亚铁离子被氧化生成铁离子,同时还生成水,根据反应物和生成物书写离子方程式为6Fe2++Cr2O72-+14H+═6Fe3++2Cr3++7H2O;
(5)酸性 K2Cr2O7 溶液具有强氧化性和酸性,应该盛放在酸式滴定管中,所以该实验滴定时需要的仪器有酸式滴定管、滴定管夹、锥形瓶,所以应该选取①④⑥;
(6)得到的沉淀是BaSO4,n(BaSO4)=![]() mol,根据硫酸根离子守恒得(NH4)2Fe(SO4)26H2O~2BaSO4,则n[(NH4)2Fe(SO4)26H2O]=
mol,根据硫酸根离子守恒得(NH4)2Fe(SO4)26H2O~2BaSO4,则n[(NH4)2Fe(SO4)26H2O]=![]() n(BaSO4)=
n(BaSO4)=![]() mol,m[(NH4)2Fe(SO4)26H2O]=
mol,m[(NH4)2Fe(SO4)26H2O]=![]() mol×392g/mol×
mol×392g/mol×![]() =
=![]() g,摩尔盐纯度=
g,摩尔盐纯度=![]() ×100%=
×100%=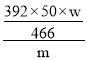 ×100%=
×100%=![]() ×100%;
×100%;
(7)Fe2+不稳定,易被空气氧化,导致方法一测定值偏小。


科目:高中化学 来源: 题型:
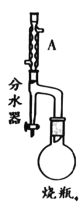
【题目】实验室制备甲基丙烯酸甲酯的反应装置示意图和有关信息如下:
 +CH3OH
+CH3OH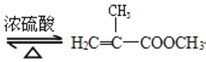 +H2O
+H2O
药品 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度(gcm-3) |
甲醇 | 32 | -98 | -64.5 | 与水混溶,易溶于有机溶剂 | 0.79 |
甲基丙烯酸 | 86 | 15 | 161 | 溶于热水,易溶于有机剂 | 1.01 |
甲基丙烯酸甲酯 | 100 | -48 | 100 | 微溶于水,易溶于有机溶剂 | 0.944 |
已知甲基丙烯酸甲酯受热易聚合;甲基丙烯酸甲酯在盐溶液中溶解度较小;CaCl2可与醇结合形成复合物;
实验步骤:
①向100mL烧瓶中依次加入:15mL甲基丙烯酸、2粒沸石、10mL无水甲醇、适量的浓硫酸;
②在分水器中预先加入水,使水面略低于分水器的支管口,通入冷凝水,缓慢加热 烧瓶。在反应过程中,通过分水器下部的旋塞分出生成的水,保持分水器中水层液面的高度不变,使油层尽量回到圆底烧瓶中;
③当 ,停止加热;
④冷却后用试剂 X 洗涤烧瓶中的混合溶液并分离;
⑤取有机层混合液蒸馏,得到较纯净的甲基丙烯酸甲酯。请回答下列问题:
(1)A装置的名称是_____。
(2)请将步骤③填完整____。
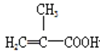
(3)上述实验可能生成的副产物结构简式为_____(填两种)。
(4)下列说法正确的是______
A.在该实验中,浓硫酸是催化剂和脱水剂
B.酯化反应中若生成的酯的密度比水大,不能用分水器提高反应物的转化率
C.洗涤剂X是一组试剂,产物要依次用饱和Na2CO3、饱和CaCl2溶液洗涤
D.为了提高蒸馏速度,最后一步蒸馏可采用减压蒸馏;该步骤一定不能用常压蒸馏
(5)实验结束收集分水器分离出的水,并测得质量为2.70g,计算甲基丙烯酸甲酯的产率约为_____。实验中甲基丙烯酸甲酯的实际产率总是小于此计算值,其原因不可能是_____。
A.分水器收集的水里含甲基丙烯酸甲酯
B.实验条件下发生副反应
C.产品精制时收集部分低沸点物质
D.产品在洗涤、蒸发过程中有损失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,体积均为V0且pH相同的MOH与ROH溶液,分别加水稀释至V,pH随![]() 变化如图所示。下列说法正确的是( )
变化如图所示。下列说法正确的是( )
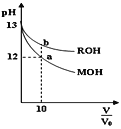
A.MOH为一元强碱
B.a点溶液的导电性大于b点溶液
C.原溶液中:c(MOH)=c(ROH)
D.水的电离程度:a点小于b点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气因热值高、来源广、产物无污染,常被人们看做一种理想的“绿色能源”,氢气的制取是氢能源利用领域的研究热点。
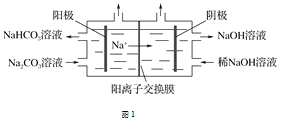
(1)图1为用电解法制备H2,写出阳极的电极反应式:____________________________。
(2)从可持续发展考虑,太阳能光解水制氢是获取H2的最好途径,但迄今仍然存在诸多问题,如光催化剂大多仅在紫外光区稳定有效,能够在可见光区使用的光催化剂不但催化活性低,而且几乎都存在光腐蚀现象,需使用牺牲剂进行抑制,能量转化效率低等,这些都阻碍了光解水的实际应用,需设计课题进一步研究解决。下列设想符合研究方向的是________。
A.将研究方向专注于紫外光区,无需考虑可见光区
B.研究光腐蚀机理,寻找高稳定性,不产生光腐蚀的制氢材料
C.研制具有特殊结构的新型光催化剂,开发低成本、高性能光催化材料
D.研究新的光解水的催化机制,使利用红外光进行光解水制氢成为可能
(3)以甲烷为原料制取氢气是工业上常用的制氢方法。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH1=-206.2 kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH2=-247.4 kJ·mol-1
则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为:__________________________________。
(4)利用废弃的H2S的热分解可生产H2:2H2S(g)2H2(g)+S2(g)。现将0.30 mol H2S(g)通入到压强为p的恒压密闭容器中,在不同温度下测得H2S的平衡转化率如图2所示:
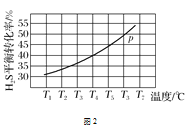
①温度为T4 ℃时,初始体积为1 L,t分钟后,反应达到平衡,该温度下的平衡常数K=________。
②若保持恒温T ℃,将一定量的H2S(g)通入到恒压密闭容器中,反应一段时间后,压强为p的体系恰好达到平衡,试在图3上画出不同起始压强下H2S转化率的趋势图。 _________________
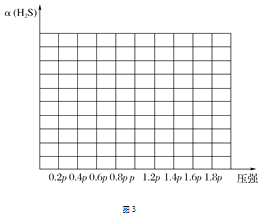
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2和Zn是制造普通干电池的重要原料,现用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制备MnO2和Zn的工艺流程如图:
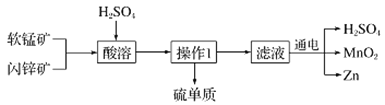
下列说法不正确的是( )
A.干电池是一种将化学能转变为电能的装置
B.酸溶时,ZnS作还原剂,每析出12.8gS沉淀,共转移0.8mol电子
C.通电电解时MnO2在阳极处生成,电极反应为:Mn2+-2e-+2H2O═MnO2+4H+
D.原料硫酸可以循环使用,且可用盐酸代替硫酸进行酸溶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知汽车发动机工作时氮气与氧气转化为一氧化氮,能量变化关系如图所示,下列有关说法正确的是
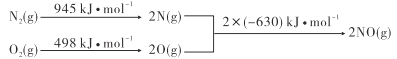
A.2NO(g)= N2(g)+O2(g)△H=+183kJ·mol-1
B.断裂1molN≡N键放出945kJ的能量
C.2molO(g)的总能量比1molO2(g)的多498kJ
D.N2(g)+O2(g)=2NO(g)的正反应活化能小于逆反应活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组热化学方程式中,化学反应的△H 前者小于后者的是
①C(s)+O2(g)═CO2(g)△H1 C(s)+![]() O2═CO(g)△H2
O2═CO(g)△H2
②S(g)+O2(g)═SO2(g)△H3 S(s)+O2(g)═SO2(g)△H4
③2H2(g)+O2(g)═2H2O(l)△H5 H2(g)+![]() O2(g)═H2O(l)△H6
O2(g)═H2O(l)△H6
④CaCO3(s)═CaO(s)+CO2(g)△H7 CaO(s)+H2O(l)═Ca(OH)2(s)△H8
A.①④B.④C.②③④D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:
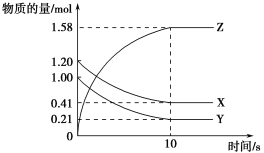
(1)从反应开始到10 s,用Z表示的反应速率为____________。X的物质的量浓度减少了___________________,Y的转化率为_____________________。
(2)该反应的化学方程式为:_________________________________。
(3)若要使反应时间缩短,可使用下列哪些方法_____________。
A.升高温度
B.增大容器的体积
C.通入He气增大容器的压强
D.加催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为我国圆明园兽首铜像—兔首和鼠首,看上去仍熠熠生辉。下列对其原因的分析最可能的是( )

A.它们表面的铜绿已用酸性溶液洗去B.利用电镀原理在其表面镀了一层耐腐蚀的黄金
C.铜的活动性很弱,与空气成分不反应D.它们是含一定比例金、银、锡、锌的铜合金
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com