
【题目】已知汽车发动机工作时氮气与氧气转化为一氧化氮,能量变化关系如图所示,下列有关说法正确的是
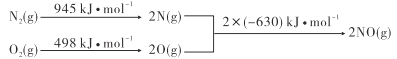
A.2NO(g)= N2(g)+O2(g)△H=+183kJ·mol-1
B.断裂1molN≡N键放出945kJ的能量
C.2molO(g)的总能量比1molO2(g)的多498kJ
D.N2(g)+O2(g)=2NO(g)的正反应活化能小于逆反应活化能
【答案】C
【解析】
A.根据图示,该反应中的反应热=反应物的键能和-生成物的键能和=(945+498)kJ/mol-2×630kJ/mol=+183kJ/mol,为吸热反应,其热化学反应方程式为:N2(g)+O2(g)=2NO(g)△H=+183 kJmol-1,则2NO(g)=N2(g)+O2(g)△H=-183kJ·mol-1,故A错误;
B.断裂化学键需要吸收能量,根据图示,断裂1molN≡N键需要吸收945kJ的能量,故B错误;
C.根据图示,1molO2(g)断开化学键形成2molO(g)时需要吸收498kJ能量,说明生成物的总能量高于反应物的总能量,化学反应中的能量变化遵循能量守恒,即2molO(g)的总能量比1molO2(g)的多498kJ,故C正确;
D.根据A项分析,N2(g)+O2(g)=2NO(g)△H=+183 kJmol-1,为吸热反应,△H=正反应活化能-逆反应活化能>0,即正反应活化能大于逆反应活化能,故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】从某矿渣(成分为NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等)中回收NiSO4的工艺流程如图:
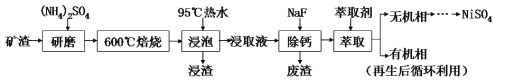
已知:(NH4)2SO4在350℃分解生成NH3和H2SO4;NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。
回答下列问题:
(1)“研磨”的目的是___。
(2)矿渣中部分FeO在空气焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为____。
(3)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为___。“浸渣”的成分除Fe2O3、FeO(OH)、CaSO4外还含有___(填化学式)。
(4)向“浸取液”中加入NaF以除去溶液中Ca2+,溶液中c(F-)至少为___mol·L-1时,可使钙离子沉淀完全。[已知Ca2+浓度小于1.0×10-5mol·L-1时沉淀完全;Ksp(CaF2)=4.0×10-11]
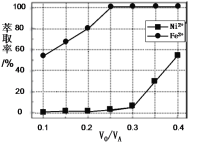
(5)萃取可用于对溶液中的金属离子进行富集与分离:Fe2+(水相)+2RH(有机相)![]() FeR2(有机相)+2H+(水相)。萃取剂与溶液的体积比(
FeR2(有机相)+2H+(水相)。萃取剂与溶液的体积比(![]() )对溶液中Ni2+、Fe2+的萃取率影响如图所示,
)对溶液中Ni2+、Fe2+的萃取率影响如图所示,![]() 的最佳值为___。在___(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
的最佳值为___。在___(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
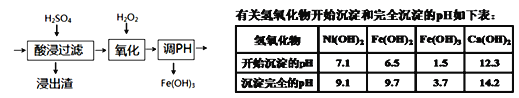
(6)若将流程图中浸泡步骤改为如图步骤(前后步骤不变)。依据下表数据判断,调pH范围为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M 均为中学化学中常见物质,一定条件下它们之间有如下转化关系(其它产物已略去)。下列说法中不正确的是( )
![]()
A.若 M 是单质铁,则 Z 溶液可能是 FeCl2 溶液
B.若 M 是氢氧化钠,则 X 水溶液呈酸性
C.若 M 是氧气,则 X、Z 的相对分子质量可能相差 48
D.若 M 是强氧化性的单质,则 X 可能是金属铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应![]()
![]() ,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是( )
,若在恒压绝热容器中发生,下列选项表明反应一定已达平衡状态的是( )
A.容器内的温度不再变化
B.容器内的压强不再变化
C.相同时间内,断开![]() 键的数目和生成
键的数目和生成![]() 键的数目相等
键的数目相等
D.容器内气体的浓度![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫尔盐[硫酸亚铁铵,(NH4)2Fe(SO4)26H2O,Mr=392]是一种重要的还原剂,在空气中比一般的亚铁盐稳定,易溶于水,难溶于乙醇。某学习小组设计如下实验制备少量的莫尔盐并测定其纯度。

回答下列问题:
Ⅰ.制取莫尔盐
i.连接装置,检査装置气密性。将13.2g(NH4)2SO4晶体置于三颈烧瓶B中,将6.0g洁净铁屑加入锥形瓶中。
ii.打开仪器a瓶塞,关闭活塞K3,打开K2、K1,加完55.0mL2mol·L-1稀硫酸后关闭K1。
iii.待大部分铁粉溶解后,打开K3、关闭K2,A中浅绿色溶液流入B。
iv.关闭活塞K2、K3,采用100℃水浴蒸发三颈烧瓶中水分,液面产生晶膜时,停止加热,冷却结晶、过滤、洗涤晶体。
(1)仪器a的名称是___。
(2)操作iii中浅绿色溶液会流入B的原因是___。
(3)操作iv中洗涤晶体所用试剂是___(填标号)。
A.水 B.无水乙醇 C.硫酸溶液
Ⅱ.为测定所得莫尔盐晶体纯度,取mg该样品配制成1L溶液,分别设计如下两个实验方案,请回答:
方案一:取20.00mL所配硫酸亚铁铵溶液用0.1000mol·L-1的酸性K2Cr2O7溶液进行滴定。重复三次。(已知:Cr2O72-还原产物为Cr3+)
(4)写出此反应的离子方程式___。
(5)滴定时必须选用的仪器是___。(填标号)
方案二:取20.00mL所配硫酸亚铁铵溶液进行如下实验。
![]()
(6)莫尔盐晶体纯度为___。(用含m、w的式子表示)
(7)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应H2(g)+ I2(g) 2HI(g) △H<0在一密闭体系中达到化学平衡。在448℃时,该反应的化学平衡常数为49。
(1)请写出该反应的平衡常数的表达式__________。
(2)下列说法中能说明该反应已达平衡状态的是______________(用字母序号填空)
A.压强不再改变
B.速率之比 v(H2):v(I2):v(HI)=1:1:2
C.混合气体的颜色不再改变
D.混合气体的密度不再改变
(3)只改变下列条件,该化学平衡如何移动?①向正反应方向移动;②向逆反应方向移动;③不移动。升高温度__________;(用数字序号填空,下同)缩小容器的体积___________;保持体积不变,通入氢气___________;保持压强不变,通入氩气____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为石油裂解的主要产物,相对分子质量为28。B为气体,在标准状况下的密度为1.965g·L-1。D与F互为同分异构体,F是环状化合物。G的结构简式为:![]() 。在一定条件下,它们有如图所示的转化关系。
。在一定条件下,它们有如图所示的转化关系。
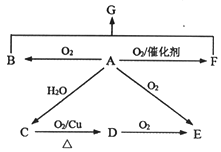
请回答:
(1)E中所含官能团名称________。
(2)B与F反应生成G的反应类型________。
(3)C→D的化学方程式________。
(4)下列说法正确的是________。(填编号)
A.A与O2在催化剂作用下反应也可以生成D B.不可以用金属钠检验C中是否含有少量水
C.可以用NaHCO3溶液鉴别C、D、E的水溶液 D.G可以在NaOH溶液或稀硫酸中发生水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业制备镓的流程如图所示:
![]()
下列判断不合理的是( )
A. Al、Ga均处于ⅢA族B. Ga2O3可与盐酸反应生成GaCl3
C. 酸性:Al(OH)3>Ga(OH)3D. Ga(OH)3可与NaOH反应生成NaGaO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com