
【题目】下列物质的分离提纯中除杂剂及相应的化学方程式分别为
混合物成分 | 除杂试剂 | 化学方程式 |
(i)铜粉中混有铁粉 | ||
(ii)铁粉中混有铝粉 | ||
(iii)Al2O3中混有Al(OH)3 | ||
(iv)FeCl3溶液中混有FeCl2 |
【答案】稀盐酸;Fe+2HCl=FeCl2+H2↑;NaOH溶液;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;加热;2Al(OH)3 ![]() Al2O3+3H2O;氯水;Cl2+2FeCl2=2FeCl3
Al2O3+3H2O;氯水;Cl2+2FeCl2=2FeCl3
【解析】解:(i)Cu中混有Fe,可以用稀盐酸除去Fe,稀盐酸和Fe反应生成可溶性的盐,但Cu不反应,化学方程式为 Fe+2HCl=FeCl2+H2↑;(ii)Fe和NaOH溶液不反应,Al和NaOH溶液反应生成可溶性的偏铝酸钠,所以可以用NaOH溶液除去杂质,反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑;(iii)加热条件下氢氧化铝分解生成氧化铝,所以采用加热的方法除去氢氧化铝,反应方程式为2Al(OH)3 ![]() Al2O3+3H2O;(iv)氯化亚铁和氯气反应生成氯化铁,所以可以用氯水除去氯化亚铁,反应方程式为Cl2+2FeCl2=2FeCl3 , 所以答案是:
Al2O3+3H2O;(iv)氯化亚铁和氯气反应生成氯化铁,所以可以用氯水除去氯化亚铁,反应方程式为Cl2+2FeCl2=2FeCl3 , 所以答案是:
混合物成分 | 除杂试剂 | 化学方程式 |
(i)铜粉中混有铁粉 | 稀盐酸 | Fe+2HCl=FeCl2+H2↑ |
(ii)铁粉中混有铝粉 | NaOH溶液 | 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ |
(iii)Al2O3中混有Al(OH)3 | 加热 | 2Al(OH)3 |
(iv)FeCl3溶液中混有FeCl2 | 氯水 | Cl2+2FeCl2=2FeCl3 |


 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】中国古代四大发明之一﹣﹣黑火药,它的爆炸反应为:2KNO3+3C+S ![]() A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
①除S外,上列元素的电负性从大到小依次为 . 除K、S外第一电离能从大到小的顺序为 .
②在生成物中,A的晶体类型为 , 含极性共价键的分子的中心原子轨道杂化类型为 .
③CN﹣与N2互为 , 推算HCN分子中σ键与π键数目之比 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏伽德罗常数,则下列说法正确的是( )
A.1 L 0.1 mol/LNaHSO4溶液中含有0.1 NA个HSO4﹣
B.已知反应:5Cl﹣+ClO3﹣+6H+=3Cl2+3H2O,每生成71g Cl2 , 则转移2NA个电子
C.乙烯(C2H4)和环丙烷(C3H6)组成的28g混合气体中含有氢原子数为4NA个
D.标准状况下,22.4LCCl4中含有NA个CCl4分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在5mL0.02mol/L某金属氯化物(MCln)溶液中,滴加0.05mol/L AgNO3溶液,生成沉淀质量与加入AgNO3溶液体积关系如图所示,则该氯化物中金属元素的化合价为( ) 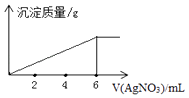
A.+1
B.+2
C.+3
D.+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种具有耐高温、抗冲击、导热性好等优良性质的物质,被广泛应用于电子工业、陶瓷工业。在一定条件下,氮化铝可通过如下反应合成:![]() 。下列叙述正确的是
。下列叙述正确的是
A. 在该反应中,N2是还原剂,Al2O3是氧化剂
B. 在该反应中,每当生成2mol AlN,N2失去6mol电子
C. 氮化铝中氮元素的化合价为-3价
D. AlN既是氧化产物又是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类合理的是
A. 碱性氧化物:Na2O、CaO、Mn2O7、Al2O3
B. 氧化物:CO2、NO、SO2、H2O
C. 铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3·H2O
D. 碱:NaOH、KOH、Ba(OH)2、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量相同的两种气体,在相同条件下,则它们必然 ( )
A. 具有相同数目的原子 B. 具有相同数目的分子
C. 具有相同的质量 D. 都占22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,加热等物质的量的NaHCO3和Na2O2的固体混合物,充分反应后,容器中固体剩余物是( )
A. Na2CO3和Na2O2 B. Na2CO3和NaOH
C. NaOH和Na2O2 D. NaOH、Na2O2和Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com