
【题目】下列物质的分类合理的是
A. 碱性氧化物:Na2O、CaO、Mn2O7、Al2O3
B. 氧化物:CO2、NO、SO2、H2O
C. 铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3·H2O
D. 碱:NaOH、KOH、Ba(OH)2、Na2CO3
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
A.标准状况下,6.72LO2和N2的混合气体含有的原子数为0.6NA
B.通常状况下,8g O2和O3的混合气体含有的分子数是0.5NA
C.常温常压下,2mol/L的100mL MgCl2溶液中,含有Cl﹣ 个数为0.4NA
D.标准状况下,11.2L He分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分离提纯中除杂剂及相应的化学方程式分别为
混合物成分 | 除杂试剂 | 化学方程式 |
(i)铜粉中混有铁粉 | ||
(ii)铁粉中混有铝粉 | ||
(iii)Al2O3中混有Al(OH)3 | ||
(iv)FeCl3溶液中混有FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中碘元素的检验可经过以下四个步骤完成(已知H2O2在酸性条件下能将海带中的I氧化成I2 , I2遇淀粉变蓝),各步骤中选用的实验用品不正确的是( ) 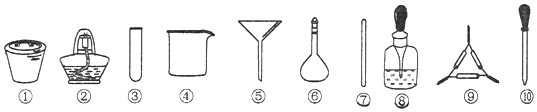
A.将海带剪碎后灼烧成灰,选用①、②和⑨
B.将海带灰加蒸馏水溶解,选用④、⑥和⑦
C.过滤得到滤液,选用④、⑤和⑦
D.取滤液,先加入几滴稀硫酸,再滴加H2O2 , 最后滴加淀粉溶液,选用③和⑩
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na+浓度为0.5 mol/L的某澄清溶液中,还可能含有下表中的若干种离子。
阳离子 | K+、Ag+、Mg2+、Ba2+ |
阴离子 | NO3-、CO32-、SiO32-、SO42- |
已知:(1)SiO32-和大量的H+会生成白色沉淀H2SiO3;
(2)H2SiO3![]() H2O+SiO2;
H2O+SiO2;
(3)产生气体为在标准状况下测定,不考虑气体在水中的溶解。现取该溶液100 mL进行如下实验:
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出0.56 L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4 g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题:
(1)实验Ⅰ能确定一定不存在的离子是______________________。
(2)实验Ⅰ中生成沉淀的离子方程式为______________________。
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)。
阴离子 | NO3- | CO32- | SiO32- | SO42- |
c/mol·L-1 | ______ |
(4)判断K+是否存在,若存在求其最小浓度,若不存在说明理由:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的两种一元酸x和y,体积均为100mL,稀释过程中pH与溶液体积的关系如图所示.分别滴加NaOH溶液(c=0.1mol/L)至pH=7,消耗NaOH溶液的体积为Vx、Vy , 则( ) 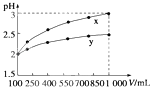
A.x为弱酸,Vx<Vy
B.x为强酸,Vx>Vy
C.y为弱酸,Vx<Vy
D.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL 0.1000molL﹣1 (NH4)2SO4溶液中逐滴加入0.2000molL﹣1 NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( ) 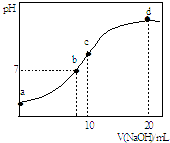
A.点a所示溶液中:c(SO42﹣)>c(NH4+)>c(H+)>c(OH﹣)
B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH﹣)
C.点d所示溶液中:c(SO42﹣)>c(NH3H2O )>c(OH﹣)>c(NH4+)
D.点c所示溶液中:c(SO42﹣)+c(H+)=c(NH3H2O )+c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:O2(g)+2H2(g)=2H2O(g)△H=﹣483.6kJmol﹣1
C(s,石墨)+O2(g)=CO2(g)△H=﹣393.5kJmol﹣1
CO2(g)+C(s,石墨)=2CO(g)△H=+172.5kJmol﹣1
(1)请写出CO与水蒸汽反应的热化学方程式
(2)在一体积为10L的密闭容器中,通入一定量的CO和水蒸汽,在850℃时发生反应,容器中CO和水蒸汽浓度变化如图,则0~4min的平均反应速率v(CO)= , 请计算此时的平衡常数K= . 
时间/min | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表.
①表中3min~4min之间反应处于状态;c1数值0.08mol/L (填大于、小于或等于).
②反应在4min~5min间,平衡向逆方向移动,可能是以下的原因(填字母),表中5min~6min之间数值发生变化,可能的原因是 . (填字母)
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com