
【题目】在Na+浓度为0.5 mol/L的某澄清溶液中,还可能含有下表中的若干种离子。
阳离子 | K+、Ag+、Mg2+、Ba2+ |
阴离子 | NO3-、CO32-、SiO32-、SO42- |
已知:(1)SiO32-和大量的H+会生成白色沉淀H2SiO3;
(2)H2SiO3![]() H2O+SiO2;
H2O+SiO2;
(3)产生气体为在标准状况下测定,不考虑气体在水中的溶解。现取该溶液100 mL进行如下实验:
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出0.56 L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4 g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题:
(1)实验Ⅰ能确定一定不存在的离子是______________________。
(2)实验Ⅰ中生成沉淀的离子方程式为______________________。
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)。
阴离子 | NO3- | CO32- | SiO32- | SO42- |
c/mol·L-1 | ______ |
(4)判断K+是否存在,若存在求其最小浓度,若不存在说明理由:_________________。
【答案】 Ag+ Mg2+ Ba2+ 2H+ + SiO32- == H2SiO3↓
阴离子 | NO3- | CO32- | SiO32- | SO42- |
c/mol·L-1 | ? | 0.25 | 0.4 | 0 |
0.8 mol/L
【解析】(1)实验Ⅰ,向溶液中加入足盐酸,产生白色沉淀并放出0.56 L气体,根据表格所提供的离子可知,该气体一定是CO2,溶液中一定含有CO32﹣,且c(CO32﹣)= ![]() =0.25mol/L;溶液中存在CO32﹣时,一定没有Ag+、Mg2+、Ba2+;
=0.25mol/L;溶液中存在CO32﹣时,一定没有Ag+、Mg2+、Ba2+;
故答案为:Ag+、Mg2+、Ba2+;
(2)加入盐酸,由生成白色沉淀判断溶液中一定含有SiO32﹣,发生反应SiO32﹣+2H+=H2SiO3↓。故答案为:SiO32﹣+2H+=H2SiO3↓;
(3)实验Ⅱ,H2SiO3加热分解生成SiO2,m(SiO2)=2.4g,根据硅原子守恒,c(SiO32﹣)= ![]() =0.4mol/L。实验Ⅲ,向Ⅱ的滤液中滴加BaCl2溶液,无明显现象,则溶液中不含SO42﹣。根据电荷守恒2c(CO32﹣)+2c(SiO32﹣)=2×0.25mol/L+2×0.4mol/L=1.3mol/L>c(Na+)=0.5mol/L,因此溶液中一定含有K+,且其浓度至少为0.8mol/L。根据以上计算可知,不能确定NO3﹣,c(CO32﹣)=0.25mol/L,c(SiO32﹣)=0.4mol/L,c(SO42﹣)=0。
=0.4mol/L。实验Ⅲ,向Ⅱ的滤液中滴加BaCl2溶液,无明显现象,则溶液中不含SO42﹣。根据电荷守恒2c(CO32﹣)+2c(SiO32﹣)=2×0.25mol/L+2×0.4mol/L=1.3mol/L>c(Na+)=0.5mol/L,因此溶液中一定含有K+,且其浓度至少为0.8mol/L。根据以上计算可知,不能确定NO3﹣,c(CO32﹣)=0.25mol/L,c(SiO32﹣)=0.4mol/L,c(SO42﹣)=0。
故答案为:
阴离子 | NO3- | CO32- | SiO32- | SO42- |
c/mol·L-1 | ? | <>0.25 | 0.4 | 0 |
(4)根据(3)问中的分析,可知,溶液中一定存在K+,且其浓度至少为0.8mol/L。
故答案为:0.8 mol/L。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】在不同温度下,将2mol X,2mol Y分别充入到不同体积的容器中,发生反应:X(g)+Y (g)mZ(g)△H,所得Z的平衡浓度如表所示,下列说法正确的是( )
| 1 | 2 | 3 |
200 |
|
|
|
300 | 2.4 | 1.2 | 0.8 |
400 | 2.0 | 1.0 |
|
A.m=2,△H>0
B.300℃时,该反应平衡常数 K=9
C.在3L容器中进行反应,达到平衡的时间:400℃>200℃
D.200℃,2L容器中反应达平衡后,再充入2 mol Z,平衡时 Z 的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏伽德罗常数,则下列说法正确的是( )
A.1 L 0.1 mol/LNaHSO4溶液中含有0.1 NA个HSO4﹣
B.已知反应:5Cl﹣+ClO3﹣+6H+=3Cl2+3H2O,每生成71g Cl2 , 则转移2NA个电子
C.乙烯(C2H4)和环丙烷(C3H6)组成的28g混合气体中含有氢原子数为4NA个
D.标准状况下,22.4LCCl4中含有NA个CCl4分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝(AlN)是一种具有耐高温、抗冲击、导热性好等优良性质的物质,被广泛应用于电子工业、陶瓷工业。在一定条件下,氮化铝可通过如下反应合成:![]() 。下列叙述正确的是
。下列叙述正确的是
A. 在该反应中,N2是还原剂,Al2O3是氧化剂
B. 在该反应中,每当生成2mol AlN,N2失去6mol电子
C. 氮化铝中氮元素的化合价为-3价
D. AlN既是氧化产物又是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类合理的是
A. 碱性氧化物:Na2O、CaO、Mn2O7、Al2O3
B. 氧化物:CO2、NO、SO2、H2O
C. 铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3·H2O
D. 碱:NaOH、KOH、Ba(OH)2、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示细胞内某些有机物的元素组成和功能关系,其中A、B代表元素,Ⅰ、Ⅱ、Ⅲ、Ⅳ是生物大分子,图中X、Y、Z、P分别为构成生物大分子的基本单位.请回答下列问题:
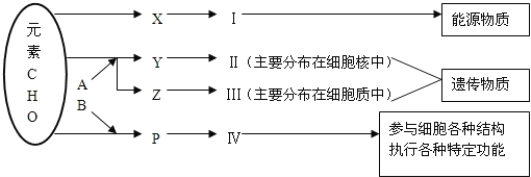
(1)图中X是________,Ⅰ在植物细胞中主要是指___________。
(2)与Ⅳ相比,Ⅱ特有的元素是_____。
(3)鉴定Ⅳ使用_______试剂,反应呈现______色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量相同的两种气体,在相同条件下,则它们必然 ( )
A. 具有相同数目的原子 B. 具有相同数目的分子
C. 具有相同的质量 D. 都占22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的晶体中化学键类型相同,晶体类型也相同的是( )
A. SO2和SiO2B. CO2和H2OC. NaCl和HClD. NaOH和Na2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的铝粉、氧化铝、氧化镁的混合物加入到300mL4mol/L的稀硫酸中,生成标准状况下6.72L气体。向反应后的溶液中滴加一定物质的量浓度的KOH溶液时,所得沉淀的物质的量(mol)与滴加KOH溶液的体积(mL)之间的关系如图所示:
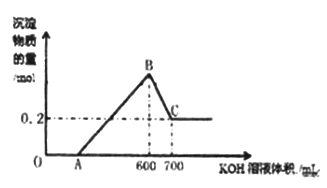
(1)OA对应反应的离子方程式为________________,BC对应反应的离子方程式为_________________;
(2)c(KOH)=_________mol/L,混合物中氧化铝的物质的量为_____mol;
(3)A点对应的数值为_______;
(4)在中学阶段,实验室里检验B点对应的溶液中的阳离子时,所观察到的现象是___________。
(5)向C点对应的溶液中通入足量的CO2所发生反应的离子方程式为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com