
| A. | 甲烷 | B. | 乙烯 | C. | 乙炔 | D. | 甲苯 |
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用NaOH溶液除去铝箔表面的氧化膜 Al2O3+2OH-═2AlO2-+H2O | |
| B. | 向AlCl3溶液中加入过量氨水 Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 用胃舒平(复方氢氧化铝)缓解胃酸(HCl)过多 OH-+H+═H2O | |
| D. | 向污水中投放明矾,生成能凝聚悬浮物的胶体Al3++3H2O?Al(OH)3 (胶体)+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加酚酞的氨水中加入氯化铵固体后红色变浅 | |
| B. | 棕红色的NO2加压后颜色先变深后变浅(已知:2NO2 (g)?N2O4 (g)) | |
| C. | 工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率 | |
| D. | 用硫酸氢钠去除暖水瓶中的水垢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽车底盘喷涂油漆 | B. | 掺防腐的金属制成不锈钢菜刀 | ||
| C. | 地下钢管连接锌块 | D. | 钢闸门连接电源负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
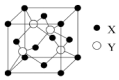 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1;元素Y基态原子的3p轨道上有5个电子;元素Z的原子最外层电子数是其内层电子数的3倍;元素W基态原子的核外电子共有16种运动状态.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1;元素Y基态原子的3p轨道上有5个电子;元素Z的原子最外层电子数是其内层电子数的3倍;元素W基态原子的核外电子共有16种运动状态.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com