
 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1;元素Y基态原子的3p轨道上有5个电子;元素Z的原子最外层电子数是其内层电子数的3倍;元素W基态原子的核外电子共有16种运动状态.
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为1;元素Y基态原子的3p轨道上有5个电子;元素Z的原子最外层电子数是其内层电子数的3倍;元素W基态原子的核外电子共有16种运动状态.分析 元素X 位于第四周期,其基态原子的内层轨道全部排满电子,则内层电子数=2+8+18=28,且最外层电子数为1,所以该原子有29个电子,为Cu元素;元素Y基态原子的3p轨道上有5个电子,则Y是Cl元素;元素Z的原子最外层电子数是其内层的3倍,元素最外层电子数小于或等于8,所以Z是O元素,元素W基态原子的核外电子共有16种运动状态,故W是S元素,以此解答该题.
解答 解:元素X 位于第四周期,其基态原子的内层轨道全部排满电子,则内层电子数=2+8+18=28,且最外层电子数为1,所以该原子有29个电子,为Cu元素;元素Y基态原子的3p轨道上有5个电子,则Y是Cl元素;元素Z的原子最外层电子数是其内层的3倍,元素最外层电子数小于或等于8,所以Z是O元素,元素W基态原子的核外电子共有16种运动状态,故W是S元素,
(1)①元素Y为Cl,Cl有3个电子层,最外层7个电子,故处于周期表中第三周期第ⅦA族,元素X为Cu,处于周期表中ds区,
故答案为:ds; 第三周期ⅦA族;
②O所在周期为第二周期,其中第一电离能最大的元素是氖,
故答案为:氖;
③X为Cu,Cu+的核外电子排布式为:1s22s22p63s23p63d10,
故答案为:1s22s22p63s23p63d10;
④Cl和S两元素所形成的最高价氧化物对应的水化物分别为H2SO4和HClO4,元素的非金属性越强,其最高价氧化物水化物的酸性越强,由于非金属性Cl>S,故酸性较强的是HClO4,
故答案为:HClO4;
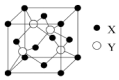
(2)Cu与Cl所形成化合物晶体的晶胞如图所示,1个晶胞中Cu为:8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Cl为:4,故此晶胞中Cu与Cl的个数比为1:1,故化学式为:CuCl,
故答案为:4; CuCl;
(3)①在乙醇中的溶解度:O的氢化物(H2O)大于H2S,其主要原因是:水分子与乙醇分子间能形成氢键,且水分子和乙醇分子中均有羟基,结构相似,
故答案为:水分子与乙醇分子间能形成氢键;且水分子和乙醇分子中均有羟基;
②由于O原子的比较小于S原子,故H2O分子内H-O的键能大于H2S分子内H-S的键能,或氧元素非金属性大于硫元素的非金属性;或H-O键的键长小于H-S键的键长,
故答案为:>;H2O分子内H-O的键能大于H2S分子内H-S的键能(或氧元素非金属性大于硫元素的非金属性;或H-O键的键长小于H-S键的键长).
点评 本题主要考查的是元素的推断以及元素周期律的应用,为高考常见题型,侧重于学生的分析能力和计算能力的考查,涉及元素位置推断、离子核外电子排布式书写、化学反应方程式书写等,平时学习应注意总结归纳.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二甲醚与乙醇互为同分异构体 | |
| B. | CH3OCH3中只含有极性共价键 | |
| C. | CH3OH和乙醇均可发生消去反应 | |
| D. | 水煤气合成二甲醚的热化学方程式:3H2(g)+3CO(g)═CH3OCH3 (g)+CO2(g)△H=-248.4kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.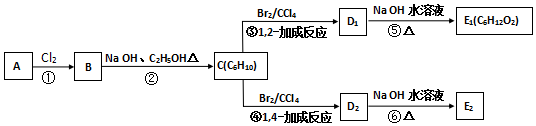
 ,C的化学名称为2,3-二甲基-1,3-丁二烯,E2的结构简式是
,C的化学名称为2,3-二甲基-1,3-丁二烯,E2的结构简式是 ,②的反应类型是消去反应.
,②的反应类型是消去反应. +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$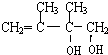 +2NaBr.
+2NaBr.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| B. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| C. | 晶格能由大到小:NaF>NaCl>NaBr>NaI | |
| D. | 熔点由高到低:Na>Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫单质在过量的空气中燃烧生成SO3 | |
| B. | 自然界的硫元素主要以硫单质、硫化物和硫酸盐等形式存在 | |
| C. | 二氧化硫和氯气使品红溶液褪色的原理相同 | |
| D. | 浓硫酸与碳在一定条件下的反应,体现了浓硫酸的强氧化性与酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 部分短周期元素化合价与原子序数的关系可用图表示.
部分短周期元素化合价与原子序数的关系可用图表示.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com