
【题目】已知草酸为二元弱酸:H2C2O4![]() HC2O4﹣+ H+ Ka1 ; HC2O4﹣
HC2O4﹣+ H+ Ka1 ; HC2O4﹣![]() C2O42﹣+H+ Ka2,T℃常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4﹣、C2O42﹣三种,微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
C2O42﹣+H+ Ka2,T℃常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4﹣、C2O42﹣三种,微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是

A. T℃时,lgKa2=-4.2
B. pH=1.2溶液中:c(K+)+c(H+)=c(OH﹣)+c(H2C2O4)
C. pH=2.7溶液中:![]()
D. 向pH=1.2的溶液中再加KOH溶液,将pH增大至4.2的过程中水的电离度一直增大
【答案】C
【解析】
A.由图像可知, T℃时,lgKa2=-4.2,A项正确;B. pH=1.2时,H2C2O4、HC2O4﹣的物质的量分数相等,且c(K+)+c(H+)=c(OH﹣)+c(HC2O4﹣),则c(K+)+c(H+)=c(OH﹣)+c(H2C2O4),B项正确;C.由图象可以知,pH=1.2时,c(H2C2O4) =c(HC2O4-) ,则Ka1=c(H+)=10-1.2;pH=4.2时,c(C2O42-) =c(HC2O4-) ,则Ka2=c(H+)=10-4.2;由电离常数可以知道![]() ,C项错误; D.向pH=1.2的溶液中加KOH溶液将pH增大至4.2,溶液中由酸电离的氢离子浓度减小,则对水的电离抑制的程度减小,水的电离度一直增大,D项正确。答案选C。
,C项错误; D.向pH=1.2的溶液中加KOH溶液将pH增大至4.2,溶液中由酸电离的氢离子浓度减小,则对水的电离抑制的程度减小,水的电离度一直增大,D项正确。答案选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】I.按要求完成下列问题:
(1)同温同压下蒸气的密度是H2的43倍的烷烃的分子式____,其中一氯代物只有2种的结构简式为____。
(2)碳原子数是5的烷烃的同分异构体有_____种,其中含有甲基个数最多的结构简式为:______该物质的习惯命名为____。
(3)分子中含有26个电子的烷烃的二氯代物有_____种,其不含甲基的结构简式为:___。
(4)碳原子数小于10的烷烃中一氯代物只有一种结构的物质有_____种,其中含有碳原子个数最少的物质的电子式为:____。
请总结书写烷烃同分异构体的方法(至少两点)____
II.现有①CH4 ②C2H4 ③C6H6三种有机物:
(1)等质量的三种烃完全燃烧时生成水最多的是______;生成CO2最多的是______;消耗氧气最多的是______。(填序号,下同)
(2)同状况、同体积的三种烃完全燃烧时耗去O2的量最多的是______。
(3)在150℃、1.01×105 Pa下时,有两种烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是__。
请总结书写烃的燃烧的规律(至少两点)_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三峡工程是目前世界上最大的水利枢纽,它所提供的清洁、廉价、再生的水电,相当于每年燃烧5 000万吨原煤的火力发电厂产生的电能,因此三峡工程的建成和使用有助于控制( )。
①氮氧化物的排放 ②酸雨的形成 ③臭氧层空洞扩大
④温室效应 ⑤白色污染
A.①②B.②④C.③④D.①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将某溶液逐滴加入氢氧化铁胶体中,开始时产生沉淀,继续滴加时沉淀又溶解,则该溶液是( )
A.2mol·L-1氯化钾溶液
B.2mol·L-1酒精溶液
C.2mol·L-1蔗糖溶液
D.2mol·L-1硝酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】假设 x 是ⅡB族中元素的原子序数, 那么原子序数为 x+1 的元素在( )
A. ⅢB 族 B. Ⅰ B 族 C. ⅢA 族 D. Ⅱ A 族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废气中的含氮氧化物是主要的大气污染物,因此脱出废气中的含氮氧化物对于保护大气环境具有重要的意义。
(1)汽车的大量使用是城市大气中含氮氧化物的主要来源。
①汽车燃油中一般不含有氮元素,汽车尾气中的NO是如何产生的?___________(用化学方程式表示)。
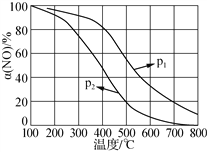
②NO易被O2氧化为NO2。其他条件不变时,NO的氧化率[α(NO)%]与温度、压强的关系如图所示。则p1________p2(填“>”、“<”或“=”);温度高于800℃时,α(NO)几乎为0的原因是_____。
(2)利用氨气脱除NO是大气污染防治研究的热点,过程中涉及的反应为:
主反应:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)
4N2(g)+6H2O(g)
副反应:
①4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-905.5kJ/mol
4NO(g)+6H2O(g) ΔH=-905.5kJ/mol
②4NH3(g)+4O2(g)![]() 2N2O(g)+6H2O(g) ΔH=-1104.9kJ/mol
2N2O(g)+6H2O(g) ΔH=-1104.9kJ/mol
③4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH=-1269.0kJ/mol
2N2(g)+6H2O(g) ΔH=-1269.0kJ/mol
回答下列问题:
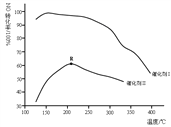
主反应的ΔH为____________________;保持其它条件相同,使用两种不同的催化剂,主反应NO的转化率与温度关系如图所示,选用催化剂I的优势有_________________(写出一点即可);R点对应的温度为210℃,低于210℃,NO的转化率是不是对应温度下的平衡转化率,请作出判断并写出理由__________________。
(3)碱液吸收法:用Na2CO3溶液吸收NO2生成CO2.若每4.6gNO2和Na2CO3溶液反应时转移电子数为0.05mol,则反应的离子方程式是__________。
(4)常温下,在通入O2的条件下用0.1mol/L的NaOH溶液吸收NO,产物为NaNO3 和NaNO2。已知反应后溶液的pH=12,溶液中NO2-浓度为5.6×10-2mol/L(忽略反应过程中溶液体积变化,HNO2的电离平衡常数Ka=5.1×10-4),则:
①![]() =________mol/L
=________mol/L
②反应后溶液中NO3-的浓度约为___________mol/L
③某溶液中c(NO2-)=1.0×10-6mol/L,取该溶液5mL,加入一滴0.1mol/L硝酸银溶液(一滴为0.05mL),通过计算说明能否产生沉淀______________。(Ksp(AgNO2)=2×10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了验证Na2CO3固体中是否含有NaHCO3,下列实验事实及判断中,正确的是 ( )
A.溶于水后加石灰水,看有无沉淀B.加稀盐酸观察是否有气体产生
C.加热后称重,看质量是否变化D.在无色火焰上灼烧,观察火焰是否呈黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为短周期元素①~⑧的部分性质,下列说法正确的是
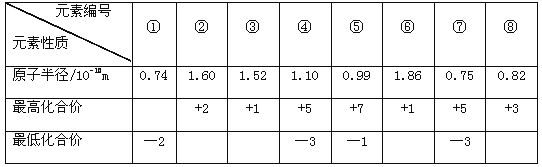
A. 元素⑦的气态氢化物稳定性比元素④的气态氢化物稳定性强
B. 元素④的最高价氧化物对应水化物的酸性比元素⑤的最高价氧化物对应水化物的酸性强
C. 元素①⑧形成的化合物具有两性
D. 上表8种元素中,元素③的最高价氧化物对应水化物的碱性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。研究发现,青铜器在潮湿环境中发生电化学腐蚀的原理示意图如下,下列说法正确的是

A. 腐蚀过程中,青铜基体是正极
B. CuCl在腐蚀过程中降低了反应的焓变
C. 若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为0.448L
D. 将糊状Ag2O涂在被腐蚀部位,可以防止青铜器进一步被腐蚀,Ag2O与催化层发生复分解反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com