
【题目】I.按要求完成下列问题:
(1)同温同压下蒸气的密度是H2的43倍的烷烃的分子式____,其中一氯代物只有2种的结构简式为____。
(2)碳原子数是5的烷烃的同分异构体有_____种,其中含有甲基个数最多的结构简式为:______该物质的习惯命名为____。
(3)分子中含有26个电子的烷烃的二氯代物有_____种,其不含甲基的结构简式为:___。
(4)碳原子数小于10的烷烃中一氯代物只有一种结构的物质有_____种,其中含有碳原子个数最少的物质的电子式为:____。
请总结书写烷烃同分异构体的方法(至少两点)____
II.现有①CH4 ②C2H4 ③C6H6三种有机物:
(1)等质量的三种烃完全燃烧时生成水最多的是______;生成CO2最多的是______;消耗氧气最多的是______。(填序号,下同)
(2)同状况、同体积的三种烃完全燃烧时耗去O2的量最多的是______。
(3)在150℃、1.01×105 Pa下时,有两种烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是__。
请总结书写烃的燃烧的规律(至少两点)_____
【答案】C6H14 (CH3)2CHCH(CH3)2 3 C(CH3)4 新戊烷 4 CH2ClCH2CH2Cl 4 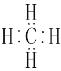 ①先写出碳原子数最多的直链烷烃,再将直链碳原子逐渐减少,减少的碳原子作为支链;②烷烃只存在碳链异构,可结合等效氢,借助取代产物的数目写出结构简式 ① ③ ① ③ ①② ①同质量的烃CxHy,
①先写出碳原子数最多的直链烷烃,再将直链碳原子逐渐减少,减少的碳原子作为支链;②烷烃只存在碳链异构,可结合等效氢,借助取代产物的数目写出结构简式 ① ③ ① ③ ①② ①同质量的烃CxHy,![]() 值越大,完全燃烧耗氧量越多,生成的H2O物质的量越大,CO2的物质的量越少;②同状况、同体积、同物质的量的烃完全燃烧,耗氧量取决于x+
值越大,完全燃烧耗氧量越多,生成的H2O物质的量越大,CO2的物质的量越少;②同状况、同体积、同物质的量的烃完全燃烧,耗氧量取决于x+![]() 的相对大小。
的相对大小。
【解析】
I. (1)同温同压下蒸气的密度是H2的43倍的烷烃的相对分子质量为43×2=86,结合烷烃的通式CnH2n+2分析,并借助等效氢原子写出满足条件的结构简式;
(2)碳原子数是5的烷烃的分子式为C5H12,共有3种同异构体;
(3)碳原子核外电子数是6,H原子核外电子数是1,结合烷烃的分子通式CnH2n+2,分析分子中含有26个电子的烷烃的分子式;
(4)碳原子数小于10的烷烃中一氯代物只有一种结构,说明分子结构中只有一种等效氢,据此分析满足条件的烷烃的分子结构;
II.(1)同质量的烃CxHy,![]() 值越大,完全燃烧耗氧量越多,生成的H2O物质的量越大,CO2的物质的量越少;
值越大,完全燃烧耗氧量越多,生成的H2O物质的量越大,CO2的物质的量越少;
(2)同状况、同体积、同物质的量的烃完全燃烧,耗氧量取决于x+![]() 的相对大小;
的相对大小;
(3)当温度大于100℃时,水为气态,当y=4时,燃烧前后体积不变。
I. (1)同温同压下蒸气的密度是H2的43倍的烷烃的相对分子质量为43×2=86,由烷烃的通式CnH2n+2可知此烷烃为C6H14,共有5种同分异构体,其中一氯代物只有2种的结构简式为(CH3)2CHCH(CH3)2;
(2)碳原子数是5的烷烃的分子式为C5H12,其同分异构体分别是正戊烷、新戊烷和异戊烷,共3种,其中甲基最多的是C(CH3)4,其烷烃的习惯命名是新戊烷;
(3)碳原子核外电子数是6,H原子核外电子数是1,结合烷烃的分子通式CnH2n+2,可知分子中含有26个电子的烷烃的分子式为C3H8,没有同分异构体,但其二氯代物共有4种,其中不含甲基的结构简式为CH2ClCH2CH2Cl;
(4) 在碳原子数n≤10的所有烷烃的同分异构体中,其一氯取代物只有一种的烷烃分别是:甲烷、乙烷、2,2-二甲基丙烷以及2,2,3,3-四甲基丁烷,共4种,其中含有碳原子数最少的是甲烷,其电子式为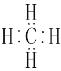 ;
;
由此可知书写烷烃同分异构体的常见方法是:①先写出碳原子数最多的直链烷烃,再将直链碳原子逐渐减少,减少的碳原子作为支链;②烷烃只存在碳链异构,可结合等效氢,借助取代产物的数目写出结构简式;
II.(1)同质量的烃CxHy,![]() 值越大,完全燃烧耗氧量越多,生成的H2O物质的量越大,CO2的物质的量越少,则同质量的CH4、C2H4、C6H6三种有机物中CH4燃烧消耗氧气最多,CH4燃烧生成的水最多,而C6H6生成的二氧化碳最多;
值越大,完全燃烧耗氧量越多,生成的H2O物质的量越大,CO2的物质的量越少,则同质量的CH4、C2H4、C6H6三种有机物中CH4燃烧消耗氧气最多,CH4燃烧生成的水最多,而C6H6生成的二氧化碳最多;
(2)同状况、同体积、同物质的量的烃完全燃烧,耗氧量取决于x+![]() 的相对大小;CH4、C2H4、C6H6三种有机物中,x+
的相对大小;CH4、C2H4、C6H6三种有机物中,x+![]() 的值分别为2、3、7.5,故同物质的量的以上物质完全燃烧时耗O2的量最多的是C6H6;
的值分别为2、3、7.5,故同物质的量的以上物质完全燃烧时耗O2的量最多的是C6H6;
(3)当温度大于100℃时,水为气态,当y=4时,燃烧前后体积不变,故相同条件下测得反应前后气体体积没有发生变化的是CH4、C2H4。
由此可总结出烃的燃烧的规律有:①同质量的烃CxHy,![]() 值越大,完全燃烧耗氧量越多,生成的H2O物质的量越大,CO2的物质的量越少;②同状况、同体积、同物质的量的烃完全燃烧,耗氧量取决于x+
值越大,完全燃烧耗氧量越多,生成的H2O物质的量越大,CO2的物质的量越少;②同状况、同体积、同物质的量的烃完全燃烧,耗氧量取决于x+![]() 的相对大小。
的相对大小。


科目:高中化学 来源: 题型:
【题目】新型锂-空气电池具有能量密度高的优点,可以用作新能源汽车的电源,其结构如图所示,其中固体电解质只允许Li+通过。下列说法正确的是
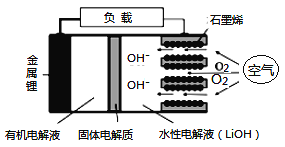
A. Li+穿过固体电解质向正极移动而得到LiOH溶液
B. 放电时,当外电路中有1 mol e-转移时,水性电解液离子总数增加NA
C. 应用该电池电镀铜,阴极质量增加64 g,理论上将消耗11.2 L O2
D. 放电时,负极反应式:Li-e-+OH-=LiOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国首个空间实验室——“天宫一号”的供电系统中,有再生氢氧燃料电池(RFC),工作原理如下图所示,a、b、c、d均为Pt电极。

下列说法正确的是
A. B区的OH通过隔膜向a电极移动,A区pH增大
B. c是正极,电极上的电极反应为:2H++2e![]() H2↑
H2↑
C. 图中右管中的OH通过隔膜向c电极移动,d电极上发生氧化反应
D. 当有1 mol电子转移时,标准状况下,b电极理论上产生气体Y的体积为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中进行反应:2SO2(g)+O2(g) ![]() 2SO3(g),已知反应进行到10秒时,SO2、O2、SO3的物质的量分别为0.2mol、0.1mol、0.2mol,则下列说法正确的是
2SO3(g),已知反应进行到10秒时,SO2、O2、SO3的物质的量分别为0.2mol、0.1mol、0.2mol,则下列说法正确的是
A .10秒时,用O2表示该反应的平均反应速率为0.01mol/(L·s)
B.当反应达到平衡时,SO3的物质的量可能为0.4mol
C.档SO2和O2的生成速率之比为2:1时,达到该反应限度
D.向容器内充入SO2,可以提高反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知元素A的原子序数是53,请根据元素周期表的编排原则完成下列问题:
(1) A元素在周期表中的位置____。
(2) A的氢化物中含有化学键的类型____。(填共价键、离子键)
(3)与A同主族的元素形成的最高价氧化物的水化物中酸性或碱性最强的是______。(填化学式)
(4)写出A与H2反应的化学方程式_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组反应中最终肯定得到白色沉淀的是( )
A. AlCl3溶液中加入过量氨水
B. Al2(SO4)3溶液中加入过量KOH溶液
C. FeCl2溶液中加入过量氨水
D. Fe2(SO4)3溶液中加入过量KOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M、N、Q的转化关系如下图所示,下列说法正确的是

A. M 的名称是2一甲基一丁烷
B. N在NaOH 的水溶液中发生消去反应生成Q
C. Q分子中所有的碳原子一定共面
D. N 的同分异构体有7 种(不考虑立体异构,不包括本身)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸为二元弱酸:H2C2O4![]() HC2O4﹣+ H+ Ka1 ; HC2O4﹣
HC2O4﹣+ H+ Ka1 ; HC2O4﹣![]() C2O42﹣+H+ Ka2,T℃常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4﹣、C2O42﹣三种,微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是
C2O42﹣+H+ Ka2,T℃常温下,向某浓度的草酸溶液中逐滴加入一定量浓度的KOH溶液,所得溶液中H2C2O4、HC2O4﹣、C2O42﹣三种,微粒的物质的量分数(δ)与溶液pH的关系如图所示,则下列说法中不正确的是

A. T℃时,lgKa2=-4.2
B. pH=1.2溶液中:c(K+)+c(H+)=c(OH﹣)+c(H2C2O4)
C. pH=2.7溶液中:![]()
D. 向pH=1.2的溶液中再加KOH溶液,将pH增大至4.2的过程中水的电离度一直增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com