
【题目】将质量均为100g的锌片和铜片用导线与灯泡串联浸入盛有500mL 2 mol·L-1稀硫酸溶液的1.5L容器中构成如下装置。

(1)该装置中发生反应总的离子方程式为________________,溶液中______(填微粒化学式)向锌极移动。
(2)若2 min后测得锌片质量减少13g,则导线中流过的电子为__________mo1,电子的流动方向____________(用m、n表示)。若将正极生成的气体不断导入一个2L的刚性容器中,则反应开始至2min用该气体表示的反应速率为_______________。
(3)当反应进行到3min 时灯泡亮度较弱,某同学向该装置内溶液中加入__________(填序号)灯泡的亮度会突然增加。
a.300mL蒸馏水 b.100mL 8 mol·L-1硫酸溶液
c.300mL 10 mol·L-1硫酸铜溶液 d.200mL 8 mol·L-1氢氧化钠溶液
【答案】 Zn+2H+=Zn2++H2↑ SO42- 0.4 由m到 n 0.05mol·L-1·min-1 bc
【解析】(1)装置没有外加电源,属于原电池,活泼金属锌做负极,本身失电子,正极上是H+得电子,所以H+在该极附近浓度减小,正极反应和负极反应合并即为总的电池反应,离子反应式为Zn+2H+=Zn2++H2↑,溶液中的SO42-向负极Zn移动;
(2)若2 min后测得锌片质量减少13g,Zn的物质的量为![]() =0.2mol,则导线中流过的电子为0.2mol×2=0.4mo1,原电池工作时,电子的流动方向是由负极向正极移动,即由m到 n;反应中生成的氢气的物质的量为
=0.2mol,则导线中流过的电子为0.2mol×2=0.4mo1,原电池工作时,电子的流动方向是由负极向正极移动,即由m到 n;反应中生成的氢气的物质的量为![]() =0.2mol,则反应开始至2min用该气体表示的反应速率为
=0.2mol,则反应开始至2min用该气体表示的反应速率为 =0.05mol·L-1·min-1;
=0.05mol·L-1·min-1;
(3)当反应进行到3min 时灯泡亮度较弱,说明溶液中硫酸基本完全反应,只需要继续添加稀硫酸或能与Zn发生反应的硫酸铜溶液即可,故答案为bc。


科目:高中化学 来源: 题型:
【题目】含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是( )
A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
B.x=0.6a,2Br-+ Cl2=Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素。其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置如下图。下列说法正确的是
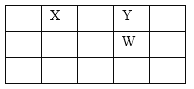
A. 五种元素中,原子半径最大的是W
B. Y与Z形成的化合物均为碱性氧化物
C. Y、Q、W形成的气态氢化物中,沸点最高的是H2Y
D. Z与Q形成的化合物水溶液一定显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化钙晶体(CaBr2·2H2O)为白色固体,易溶于水,可用于制造灭火剂、制冷剂等。一种制备溴化钙晶体的工艺流程如下:

(1)实验室模拟海水提溴的过程中,用苯萃取溶液中的溴,分离溴的苯溶液与水层的操作是(装置如下图):使玻璃塞上的凹槽对准漏斗上的小孔,将活塞拧开,使下面的水层慢慢流下,待有机层和水层界面与活塞上口相切即关闭活塞,______________。

(2)“合成”的化学方程式为___________________。 “合成”温度控制在70℃以下,其原因是__________。投料时控制n(Br2):n(NH3)= 1:0.8,其目的是__________________。
(3)“滤渣”的主要成分为_________________(填化学式)。
(4)“滤液”呈强碱性,其中含有少量BrO-、BrO3-,请补充从“滤液”中提取CaBr2·2H2O的实验操作:加热驱除多余的氨,______________。[实验中须使用的试剂有:氢溴酸、活性炭、乙醇;除常用仪器外须使用的仪器有:砂芯漏斗,真空干燥箱]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌可用于制造锌钡白、印染媒染剂等。用锌白矿(主要成分为ZnO,还含有Fe2O3、CuO、SiO2等杂成) 制备ZnSO4 ·7H2O的流程如下。

相关金属离了生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)如下表:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Zn2+ | 6.4 | 8.0 |
(1)“滤渣1”的主要成分为_________(填化学式)。“酸浸”过程中,提高锌元素浸出率的措施有:适当提高酸的浓度、______________(填一种)。
(2)“置换”过程中,加入适量的锌粉,除与溶液中的Fe3+,H+反应外,另一主要反应的化学方程式为__________________________。
(3)“氧化”一步中,发生反应的离子方程式为_______________________。溶液pH控制在[3.2,6.4)之间的目的是________________。
(4)“母液”中含有的盐类物质有_________ (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】保护环境、保护地球已成为人类共同的呼声。
(1)下列措施不利于环境保护的是___________(选填字母,下同)
A.推广使用无铅汽油 B.提倡家庭使用太阳能热水器
C.推广废旧电池单独回收 D.提倡家庭购买大排量汽车
(2)酸雨的PH<5.6,下列气体排放可能形成酸雨的是______________
A.N2 B.CO C.SO2 D.氟氯代烷
(3)下列情况可能引起大气污染的是____________
①煤的燃烧 ②工业废气任意排放 ③燃放鞭炮 ④飞机、汽车尾气的排放
A.只有①② B.只有②④
C.只有①②③ D.①②③④
(4)废弃的热塑性塑料通过清洗、熔融、重新制成塑料。塑料属于____________
A.无机非金属材料 B.有机合成材料
C.复合材料 D.合金
(5)维生素C又称为抗坏血酸,在人体内有重要功能,其结构简式如右图所示,则维生素C的分子式为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应A(g) + 3B(g)![]() 2C(g) 达到平衡的标志是( )
2C(g) 达到平衡的标志是( )
A. A、B、C的浓度不再发生变化 B. C的生成速率与B的生成速率相等
C. 单位时间内生成n molA,同时生成3n molB D. A、B、C的分子数之比为1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. H2的摩尔质量是2 B. 1molH2O 的质量是18 g /mol
C. 2g H2含1mol H D. 氧气的摩尔质量是32 g/ mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com