
【题目】下列对化学用语的理解正确的是( )
A.键线式H-C1-O可以表示次氯酸分子的结构
B.电子式![]() 可以表示氢氧根离子,也可以表示羟基
可以表示氢氧根离子,也可以表示羟基
C.结构示意图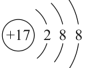 可以可以表示35Cl-,也可以表示37Cl-
可以可以表示35Cl-,也可以表示37Cl-
D.比例模型![]() 可以表示甲烷分子,也可以表示四氯化碳分子
可以表示甲烷分子,也可以表示四氯化碳分子
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有效去除大气中的H2S、SO2以及废水中的硫化物是环境保护的重要课题。
(1)去除废气中H2S的相关热化学方程式如下:
2H2S(g)+3O2(g)=2H2O(l)+2SO2(g);ΔH=akJ·mol-1
2H2S(g)+SO2(g)=2H2O(l)+3S(s);ΔH=bkJ·mol-1
反应2H2S(g)+O2(g)=2H2O(l)+2S(s)的ΔH=__kJ·mol-1。
为了有效去除废气中的H2S,在燃烧炉中通入的H2S和空气(O2的体积分数约为20%)体积比一般控制在0.4,理由是__。
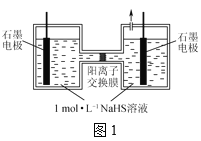
(2)电化学氧化法是一种高效去除废水中硫化物的方法,电解NaHS溶液脱硫的原理如图1所示。碱性条件下,HS-首先被氧化生成中间产物Sn2-,S n2-容易被继续氧化而生成硫单质。
①阳极HS-氧化为S n2-的电极反应式为___。
②电解一段时间后,阳极的石墨电极会出现电极钝化,导致电极反应不能够持续有效进行,其原因是___。
(3)用CO(NH2)2(N为-3价)水溶液吸收SO2,吸收过程中生成(NH4)2SO4和CO2。该反应中的氧化剂是__。
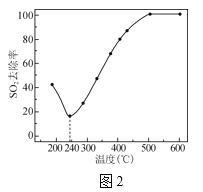
(4)在一定条件下,CO可以去除烟气中的SO2,其反应原理为2CO+SO2=2CO2+S。其他条件相同、以比表面积大的γ—Al2O3作为催化剂,研究表明,γ—Al2O3在240℃以上发挥催化作用。反应相同的时间,SO2的去除率随反应温度的变化如图2所示。240℃以前,随着温度的升高,SO2去除率降低的原因是__。240℃以后,随着温度的升高,SO2去除率迅速增大的主要原因是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓
B.将大理石投入到足量盐酸中:CO32-+2H+=CO2↑+H2O
C.将Cl2通入KI溶液中:2I-+Cl2=2Cl-+I2
D.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3+ +3H2O![]() Fe (OH)3↓+ 3H+
Fe (OH)3↓+ 3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲配制100mL1.0 mol/L Na2SO4溶液,正确的方法是( )
①将14.2 g Na2SO4,溶于100mL水中
②将32.2g Na2SO410H2O溶于少量水中,再用水稀释至100 mL
③将20 mL 5.0 mol/L Na2SO4溶液用水稀释至100 mL
A.①②B.②③C.①③D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青金石是碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氧、氧等元素,曾用来制作颜料。
(1)在周期表中,与Si的化学性质最相似的邻族元素是_________。
(2) Na+和 Ne互为等电子体,电离能 I2(Na)_________I1(Ne)填"〉”或“<")。
(3)已知氯、硫有多种含氧酸,HClO4中共价键类型有_____,硫酸的结构式为_____。
(4)氢卤酸(HX)的电离过程如图。△H1和△H2的递变规律:HF > HCl> HBr >HI,其中△H1(HF)特别大的原因为________,影响△H2递变的因素为________。
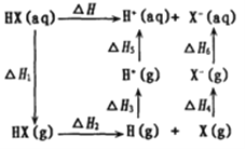
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和治疗,其制备过程如图所示,下列叙述不合理的是( )

A.在反应②中,![]() 的作用可能是促进氯化铁水解
的作用可能是促进氯化铁水解
B.直接加热FeCl3溶液也可以得到四氧化三铁
C.反应③的化学反应方程式是6FeOOH+CO=2Fe3O4+3H2O+CO2
D.纳米四氧化三铁在水中形成的分散系,有可能产生丁达尔现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相对分子质量为M的气态化合物VL(标准状况)溶于mg水中,得到溶液的质量分数为ω%,物质的量浓度cmol/L,密度为ρg/cm3,则下列说法正确的是
A. 相对分子质量M可表示为:![]()
B. 溶液密度ρ可表示为:![]()
C. 溶液的质量分数ω%可表示为:![]()
D. 物质的量浓度C可表示为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:![]() 平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
A.x+y﹤zB.平衡向正反应方向移动
C.B的转化率降低D.C的体积分数升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积相同的盐酸和醋酸溶液,c(Cl-) = c(CH3COO-)= 0.01 mol/L,下列说法正确的是
A.pH:醋酸>盐酸
B.完全反应消耗NaOH的量:醋酸>盐酸
C.与相同的Na2CO3粉末反应的起始速率:醋酸<盐酸
D.分别用水稀释相同倍数后,所得溶液中:c (Cl-) = c (CH3COO-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com