
����Ŀ��������ѧ֪ʶ������ش��������⣺
��1��д��ԭ��������С�ĵڢ���Ԫ��ԭ�ӵ�ԭ�ӽṹʾ��ͼ__________��
��2��д��3p�������2��δ�ɶԵ��ӵ�Ԫ�صķ��ţ�______________��
��3����Ԫ�ر���ѧ�ҳ�֮Ϊ������Ԫ���еġ�����֮��������ԭ�ӵ���Χ�����Ų�ʽΪ4s24p4����Ԫ�ص�������____________��
��4��NH4BF4(�������)�Ǻϳɵ��������ܵ�ԭ��֮һ��1 mol NH4BF4����____ mol��λ����
��5����ѧ��Ӧ����Ϊ�ɼ��Ķ��Ѻ��¼����γɹ��̡���ѧ���ļ������γɻ�ѧ��ʱ�ͷŵ���������֪����P4O6�ķ��ӽṹ��ͼ��ʾ�����ṩ���»�ѧ���ļ���(kJ��mol��1)��P��P��198 P��O��360 O===O��498����ӦP4(����)��3O2===P4O6�ķ�Ӧ�Ȧ�HΪ______��
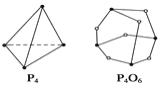
��6��д�����������е�Sԭ�Ӻ�ˮ����������Oԭ�ӷֱ����______��______�ӻ���ʽ������������Ӻ�ˮ����������ռ乹�ͷֱ�Ϊ________��__________��
��7��HFˮ��Һ�к��е������_______________�֡�
��8����ˮCoCl2Ϊ����ɫ����ˮ���Ϊ�ۺ�ɫ��ˮ���ˮ�������Ⱥ��ֱ����ˮCoCl2���ʳ���ʵ������������ʪ���Ϳ���ʪ��ָʾ����
CoCl2��xH2O �� CoCl2��xH2O
����ɫ �ۺ�ɫ
����65g��ˮCoCl2����ˮ����CoCl2��xH2O 119g����CoCl2����Է���������131��
��ˮ������x��________��
�����û�������Co2����λ��Ϊ6�����Ҿ������ⶨ��֪�ڽ�����ռ��Cl���ĸ�����Ϊ1��1�����仯ѧʽ�ɱ�ʾΪ______________________��
���𰸡�  Si��S �� 2 ��1 638 kJ��mol��1 sp2 sp 3 V�� ������ 4�� 6 [Co(H2O)5Cl]Cl��H2O
Si��S �� 2 ��1 638 kJ��mol��1 sp2 sp 3 V�� ������ 4�� 6 [Co(H2O)5Cl]Cl��H2O
��������(1)������Ԫ���������ܡ�����ԭ��������С��������ԭ�Ӻ�����26�����ӣ���ԭ�ӽṹʾ��ͼΪ�� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
(2)3p�������2��δ�ɶԵ���ʱ�����������һ������һ��3p�����û�е��ӣ�һ������һ��3p����ϳ������ӣ����Ե���һ��3p�����û�е��ӣ���ԭ����Si��һ������һ��3p����ϳ������ӣ���ԭ����S���ʴ�Ϊ��Si��S��
(3)ԭ�ӵ���Χ�����Ų���4s24p4��˵����ԭ���и���������������ӣ���ԭ�Ӻ����������34����������Ԫ�أ��ʴ�Ϊ������
��4��һ��NH4BF4��Nԭ�Ӻ�����һ��Hԭ��֮�������λ����Bԭ�Ӻ�����һ��Fԭ��֮�����һ����λ�������Ժ���2����λ������1mol NH4BF4����2mol��λ�����ʴ�Ϊ��2��
��5����ѧ������Ϊ��P-P198kJmol-1��P-O360kJmol-1��O=O498kJmol-1����Ӧ�ȵ��ʱ䣺��H=��Ӧ���ܼ���-�������ܼ��ܣ���ӦP4�����ף�+3O2=P4O6�ķ�Ӧ��Ϊ����H=6��198kJmol-1+3��498kJmol-1-12��360kJmol-1=-1638kJmol-1��
��6�����������������ԭ�Ӽ۲���Ӷ�2+1/2��(62��2)=3��Sԭ�Ӳ�ȡsp2�ӻ���Sԭ�ӹ¶Ե��Ӷ���Ϊ1���ռ乹��ΪV�Σ�ˮ������������ԭ�ӵļ۲���Ӷ�3+1/2��(613��1)=4����ԭ�ӹ¶Ե��Ӷ���Ϊ1����ԭ�Ӳ�ȡsp3�ӻ���ˮ�������ӿռ乹��Ϊ�����ͣ��ʴ�Ϊ��sp2��sp3��V�Σ������͡�
��7�����һ�����������֣�F��H��O��F��H��F��O��H��F��O��H��O���ʴ�Ϊ��4��
��8����xH2O+CoCl2=CoCl2xH2O��m
131+18x 18x
119g (11965)g
(131+18x)/119=18x/(11965)g��
��ã�x=6���ʴ�Ϊ��6��
�ڸû�����CoCl26H2O��Co2+��λ��Ϊ6�����Ҿ������ⶨ��֪���������ռ��Cl����Ϊ1:1��������1�������������ڽ��к���1�������Ӻ�5��ˮ����;�����1���������������1���ᾧˮ�����Ի�ѧʽ�ɱ�ʾΪ��[CoCl(H2O)5]ClH2O���ʴ�Ϊ��[CoCl(H2O)5]ClH2O.


 ����ѵ��ϵ�д�
����ѵ��ϵ�д� ��ĩ�����ϵ�д�
��ĩ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ѽ��仯�����ڹ�ҵ������Ҫ��;���ش��������⣺
��1��Cr��̬ԭ�Ӽ۲���ӵĹ������ʽ�������Ų�ͼ��Ϊ_________________________��
��2����������CrN���ڳ�������������������õ�Ӧ��ǰ��������CrCl3��6H2O������[(NH2)2CO]��Ӧ�ȵõ������Cr[OC(NH2)2]6Cl3��Ȼ����ͨ��NH3��N2�������ķ�Ӧ¯���ȷֽ��Ƶá����ع���Ԫ���е縺���ɴ�С��˳��Ϊ_________������̼ԭ�ӵ��ӻ�����Ϊ_________��Cr[OC(NH2)2]6Cl3���еĻ�ѧ��������__________________��
��3���������ľ���ṹ�������Ȼ��Ƶ���ͬ���������۵㣨1282�棩���Ȼ��Ƶĸߣ���Ҫԭ����_________________________________________��
��4�����ѿ�CaTiO3���͵Ľṹ�ɿ��������ﳬ����ṹ�Ļ�����Ԫ��
��ͼAΪ�������ѿ�CaTiO3���ṹ�ľ����������߳�Ϊa nm��Ca���ھ����Ķ��㣬��Ti����_________λ�ã�O����_________λ�ã���Ca���ڵ�O����Ϊ_________��Ti��O�����̾���Ϊ____________________nm ��
����ͼB�л����������ѿ��ṹ����һ�ֱ�ʾ��Ҫ��Ti���ھ����Ķ��㣻![]() ��
��![]() ��
��![]() ��������ԭ��������ͼA��ͬ��____________________��
��������ԭ��������ͼA��ͬ��____________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ˮ�ۺ����õĹ�������ͼ���ж�����˵����ȷ���� (�� ��)

��֪��MgCl2��6H2O��������Mg(OH)Cl��HCl����ȡ�
A. ���̢ٵ��ᴿ����������
B. �ڹ��̢��н�MgCl2��6H2O���ռ����Ƶ���ˮMgCl2
C. ���̢ݷ�Ӧ����Һ��ǿ���ԣ���������������豸�ĸ�ʴ����
D. ��ҵ�ϲ�����ĸҺ�м����ռ�ķ������������þ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A��P4��CH4�Ŀռ乹�ͺͼ��Ƕ���ͬ
B��O3��OF2����V���
C��SO3��SeO32-�����幹�Ͷ���������
D��HOCH2CH(OH)CH2OH��CH3CHClCH2CH3�������Է���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����A��K֮��������ͼ��ʾת����ϵ������A��һ��������ˮ�����ӻ�����ڿ������׳���ͱ��ʣ���ˮ�п��Ե��������������ȵ��������ӣ�EΪ�����г�������������Ч�ɷ֣�F�������в���ȱ�ٵĵ�ζ����GΪ��ɫҺ�壬B��C��D��K���ǵ��ʣ���Ӧ�ڡ��ݶ�����Ҫ�Ĺ�ҵ��Ӧ�������ַ�Ӧ��Ҫ����Һ�н��У�

��1������D������Ԫ�������ڱ��е�λ��Ϊ____________________________��
E��������ѧ��������___________________________________________��
M�ĽṹʽΪ___________________________________________________��
��2����Ӧ�������ӷ���ʽΪ___________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ճ������У����Ǿ�����������Ʒ���⡢����Ʒ������ְװߵ��ڶ�Ľ�����ʴ������ͨ������װ����ʾʵ�����̽��������˵����ȷ����

A. ��ͼ��װ��ʵ�飬Ϊ�˸���������ع۲쵽Һ���������ɲ������з������þƾ��Ƽ��Ⱦ�֧�Թ�
B. ͼ����ͼ����ʾװ�õ�ԭ��ʾ��ͼ��ͼ����������������
C. ����Ʒ������ְװ߿���ͨ��ͼ��װ�ý���̽����Cl���ɻ���̿��������������Ǩ�ƣ��������缫��Ӧ��2Cl����2e��=Cl2��
D. ͼ��װ�õ��ܷ�ӦΪ4Al��3O2��6H2O=4Al(OH)3�����ɵ�Al(OH)3��һ����ˮ�γɰװ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�ϵ��ȷ����
A. �е㣺����>2-������>����>����
B. 2��2��3��3���ļ����顢�����顢�����л�ѧ������ͬ��Hԭ�������ɶൽ��
C. �ܶȣ��屽 ��H2O ����
D. �����ʵ�������ȼ�պ�O2�������飾����C6H5COOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ����������ԭ��Ӧ����
A. CaCO3+2HCl=CaCl2+CO2��+ H2O
B. CaO+H2O=Ca��OH��2
C. 2H2O2![]() 2H2O+O2��
2H2O+O2��
D. CaCO3![]() CaO+CO2��
CaO+CO2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijһ��Ӧ��ϵ�з�Ӧ��������ﹲ�������ʣ�O2��KMnO4��MnSO4��H2SO4��H2O��H2O2��K2SO4����֪H2O2ֻ������ӦH2O2��O2���ش��������⣺
��1���÷�Ӧ����������________��
��2���������뻹ԭ�������ʵ���֮��______________��
��3������Ӧת����0.3mol����,���ڱ���������������___________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com